Eilon D. Kirson,1 Zoya Gurvich,2 Rosa Schneiderman,2 Erez Dekel,3 Aviran Itzhaki,4 Yoram Wasserman,1,4
Rachel Schatzberger,2 and Yoram Palti2
1Department of Biomedical Engineering, NovoCure Ltd., Haifa, Israel; 2B. Rappaport Faculty of Medicine, Technion—Israel Institute of Technology, Haifa, Israel; 3Department
of Molecular Cell Biology, Weizmann Institute of Science, Rehovot, Israel; and 4Elisha Medical Centre, Haifa, Israel
Câmpurile electrice alternative de intensitate scăzută și frecvență intermediară (100-300 kHz), administrate cu ajutorul unor electrozi izolați, s-au dovedit a avea un efect profund inhibitor asupra ratei de creștere a unei varietăți de linii de celule tumorale la om și la rozătoare (Patricia C, U-118, U-87, H-1299, MDA231, PC3, B16F1, F-98, C-6, RG2 și CT-26) și a tumorilor maligne la animale. Acest efect, dovedit a fi non-termal, afectează selectiv celulele care se divid, lăsând intacte celulele pasive. Aceste câmpuri acționează în două moduri: opresc proliferarea celulelor și distrug celulele când acestea se divid. Ambele efecte sunt evidențiate atunci când aceste câmpuri sunt aplicate timp de 24 de ore celulelor care sunt în procesul de mitoză, orientat aproximativ pe direcția câmpului.
Prima modalitate de acțiune este manifestată prin interferența cu formarea corectă a fusului mitotic, în vreme ce a doua modalitate de acțiune provoacă dezintegrarea rapidă a celulelor care se divid. Ambele efecte, fiind dependente de frecvență, sunt în concordanță cu forțele direcționale calculate, exercitate de aceste câmpuri specifice asupra încărcăturii și dipolilor din celulele care se divid. Tratamentul în vivo al tumorilor C57BL/6 și BALB/c la cobai (respectiv, B16F1 și CT-26 modele tumorale singeneice) a condus la încetinirea semnificativă a creșterii tumorii și la distrugerea masivă a celulelor tumorale în 3-6 zile. Aceste rezultate demonstrează aplicabilitatea potențială a câmpurilor electrice descrise ca modalitate terapeutică nouă pentru tumorile maligne.
Introducere
În cadrul laboratorului și în practica clinică, câmpurile electrice alternative prezintă numeroase efecte asupra țesuturilor vii. La frecvențe foarte joase (sub 1 KHz), câmpurile electrice alternative stimulează țesuturile excitabile prin fenomenul de depolarizare a membranei. Transmisia acestor câmpuri pe calea radiației este nesemnificativă și, prin urmare, aceste câmpuri sunt în mod normal aplicate direct, cu ajutorul unor electrozi de contact, deși unele aplicații au folosit electrozi izolați. Exemple binecunoscute ale efectelor produse de aceste câmpuri electrice alternative sunt stimularea nervoasă, musculară și a inimii. În plus, aceste câmpuri de joasă frecvență au capacitatea de a stimula creșterea oaselor și de a accelera vindecarea fracturilor. Totuși, pe măsură ce frecvența câmpului electric crește peste 1 kHz, efectul stimulator scade. În aceste condiții, deși o mare parte din câmp pătrunde celulele datorită faptului că toate membranele biologice au o natură de tipul rezistență-condensator în paralel, puterea de stimulare scade semnificativ deoarece ciclurile alternative de hiper-depolarizare a membranei celulare sunt integrate astfel încât efectul net este anulat. La frecvențe foarte înalte (peste câțiva MHz), deși integrarea devine chiar și mai evidentă, apare un efect biologic complet diferit. La aceste frecvențe, încălzirea țesutului devine dominantă datorită pierderilor dielectrice. Acest efect devine mai intens pe măsură ce crește frecvența, intensitatea câmpului sau disiparea la nivelul țesutului. Acest fenomen servește drept bază pentru unele modalități de tratament folosite în mod obișnuit, incluzând diatermia și ablația tumorilor cu ajutorul frecvențelor, tratamente ce pot fi aplicate cu ajutorul electrozilor izolați. Câmpurile electrice de frecvență intermediară (adică de zeci de kHz până la mHz) alternează prea repede pentru a provoca stimularea nervoasă și musculară și implică pierderi dielectrice foarte mici (încălzire). Asemenea câmpuri de intensităti mici spre mijlocii se consideră în mod obișnuit că nu au efecte biologice. Totuși, chiar și la intensități mici ale câmpului, au fost raportate un numar de efecte non-termale cu consecințe biologice minore. Aceste efecte includ alinierea particulelor microscopice (efectul șiragului de perle) și rotirea celulelor. Atunci când este vorba despre câmpuri electrice pulsatorii de 103V/cm și cu lungimea pulsului de 100 ms, la nivelul membranei celulare apare formarea reversibilă a porilor, un fenomen numit în mod obișnuit electroporare. În studiul de față este arătat faptul că câmpurile electrice alternative de intensitate foarte joasă (<2 V/cm) și frecvență intermediară (100-300 kHz), induse cu ajutorul electrozilor izolați, au efecte inhibitorii specifice asupra diviziunii celulelor din cultura de celule. Prin aceasta, studiul demonstrează că prin aplicarea acestor câmpuri la nivelul celulelor canceroase, este oprită proliferarea lor și aceste celule sunt distruse. Atunci când sunt aplicate unor modele de cobai tumorali singeneici, aceste câmpuri cu proprietatea de a trata tumorile (TTF) reduc semnificativ rata de creștere a tumorilor, fără niciun efect secundar semnificativ.
Materiale și metode
Cadrul experimental in vitro. Culturile de celule au fost crescute în cutii standard speciale (cu 4 godeuri; SN138121; Nalge Nunc International). Câmpurile TTF au fost generate de perechi de fire complet izolate de 15 mm lungime (P/N K 30-1000; VT Corporation; diametrul exterior 0,5 mm; grosimea izolației de etilenă tetrafluoroetilenă de 0,125 mm; tensiunea de străpungere a dielectricului 1800 V/mil) fixate pe fundul fiecărui godeu, la o distanță de 1 mm unul de altul. Firele au fost conectate la un oscilator (GFG8219A; Instek) și la un amplificator de înaltă tensiune (A303; A. A. Lab Systems Ltd.) care a generat semnalele sinusoidale necesare (în domeniul 300-800 V). Celulele au fost plasate prin întinderea cu atenție a 10 µl de DMEM (Biological Industries Ltd., Beit Haemek, Israel), conținând 1,5×104 celule în spațiul dintre fire. După ce celulele au fost așezate și fixate pe suprafața godeului, s-au adăugat 500 µl de DMEM în fiecare cultură de celule care, apoi, a fost transferată într-un incubator umidificat, cu 5% CO2, la 36°C. Cultura a fost incubată timp de 24 de ore înainte de tratament. Mediul de cultură a fost înlocuit manual la fiecare 24 de ore pe parcursul experimentelor. Apoi au fost aplicate TTF prin conectarea firelor la un amplificator de înaltă tensiune alimentat de un generator de semnal cu frecvență și amplitudinea controlabile. Stimularea TTF generată între fire a prezentat un câmp omogen în vecinătatea culturii de celule. Au fost supuse câmpurilor TTF 11 tipuri diferite de linii de celule canceroase. Acestea au inclus melanomul de la om (Patricia), gliomul (U-118, U-87), linii de celule canceroase de la plămân (H-1299), prostată (PC3) și sân (MDA231), precum și linii de celule de melanom de la cobai (B16F1), gliom la șobolan (F-98, C-6 si RG2) și adenocarcinom la cobai (CT-26) (toate procurate de la American Type Culture Collection, cu excepția liniei de celule Patricia, care a fost dăruită de dr. Ruth Halaban, Department of Dermatology, Yale University School of Medicine). În plus, o linie de celule necanceroase (BHK) a fost crescută în condiții care au împiedicat replicarea celulelor (0,1% FCS) și apoi a fost supusă TTF. De asemenea, fragmente din intestinul de șobolan și din diafragmă au fost supuse TTF in vitro. După însămânțarea celulelor, au fost efectuate numărători colorimetrice la fiecare 24 de ore pentru a măsura proliferarea celulelor, folosindu-se kit-ul de test pentru proliferarea celulelor (Biological Industries, Beit Haemek, Israel). Pe scurt, mediul de cultură a fost înlocuit cu 0,2 ml de reactiv de colorare și godeul s-a pus la incubat o oră la 37°C într-un incubator cu 5% CO2. După incubație și agitație ușoară, 0,15 ml din soluția de reacție a fost transferată pe o placă cu 96 de godeuri (SN92696; TPP, Trasandigen, Switzerland). Absorbția mostrelor a fost citită cu un spectrofotometru (Tecan ELISA Reader; 450 nm). Măsurătorile colorimetrice la perioade de timp prestabilite au fost comparate cu măsurătoarea făcută imediat înainte de începerea tratamentului. Pentru a verifica faptul că măsurătorile colorimetrice au fost corecte, s-a realizat și o numărătoare vizuală directă a celulelor. La densitățile optice folosite (0,2–2), densitatea optică a fost în legătură liniară cu numărul de celule din godeuri (n=10, n2=0,99). A fost calculată rata de creștere atât a culturilor de celule tratate (GRt), cât și a culturilor de celule de control (GRc) în cazul fiecărui experiment. Rata de îmbunătățire terapeutică (TER) a fost calculată ca raport între scăderea ratei de proliferare a celulelor tratate și rata de creștere a celulelor de control [(GRc-GRt)/GRc]. Astfel, dacă creșterea numărului celulelor tratate este egală cu aceea a celulelor de control, TER=0; dacă creștera numărului de celule tratate este mai mică decât în cazul celulelor de control, TER>0; și dacă numărul celulelor din culturile tratate descrește absolut, TER>1.
În experimentele în care s-a folosit microfotografierea, liniile de celule au fost crescute într-o cutie Petri standard de cultură de 35 mm (SN430165; Corning Inc.), depunând 3×104 celule în 2,5 ml de DMEM cu 25 mM HEPES. Temperatura cutiei Petri a fost stabilită la 34°C (B16F1) sau la 37°C (toate celelalte linii de celule). Apoi, au fost puse două fire izolate, paralele, pe fundul cutiei cu 1 mm distanță între ele, prin care au fost aplicate TTF. Întreg ansamblul a fost plasat sub un microscop (Eclipse TS-100; Nikon) și au fost făcute video-microfotografii cu zoom ×200, folosind o cameră VCR standard (Handicam X320; Sony). Imaginile au fost capturate, folosind un computer, la fiecare 60-120 s, timp de 6–10 ore/cultură.
Etichetarea fluorescentă a alfa-tubulinei, Actinei și ADN-ului
Celulele de melanom la cobai au fost crescute pe lamele și supuse câmpurilor TTF timp de 24 de ore. După tratament, mediul a fost îndepărtat și celulele au fost spălate într-o soluție tampon [10 mM de acid 4-morfolin etansulfonic, 150 mM NaCl, 5 mM EGTA, 5 mM MgCl2 și 5 mM glucoză (pH 6,1)], permeabilizate și fixate cu 0,5% Triton X-100 și 0,25% glutaraldehidă (Sigma) timp de 5 minute și apoi postfixate cu 1% glutaraldehidă timp de 20 de minute. Apoi, celulele au fost spălate în PBS și 1mM borohidrudră de sodiu (Sigma) pentru a elimina autofluorescența. Lamelele au fost apoi incubate cu o clonă de anticorp primar pentru alfa-tubulină (DM1A; Sigma) timp de 30 de minute, au fost spălate și incubate alte 30 de minute cu un anticorp secundar (Alexa Fluor 488 capra antișoarece IgG; Molecular Probes). În cazul anticorpului secundar a fost adăugată și o substanță pentru colorarea filamentelor de actină. Apoi, celulele au fost spălate și incubate cu 4’, 6-diamidino-fenilindol (Molecular Probes) pentru a colora ADN-ul. După colorare, lamelele au fost montate, observate cu un microscop cu fluorescență cu zoom de ×630 și fotografiate.
Măsurarea câmpului electric
Intensitatea câmpului electric în mediul de cultură a fost măsurată cu ajutorul unei probe constând din două fire izolate de 0,25 mm, cu vârfurile situate la 0,5 mm unul de altul, scufundate în mediul de cultură. Firele au fost legate la un amplificator diferențial cu impedanță mare la intrare, care a tradus amplitudinea formei de undă într-un voltaj constant calibrat, înregistrat digital. Intensitățile câmpului sunt exprimate în amplitudinea voltajului de vârf per centimetru (V/cm). S-au luat măsuri de prevedere pentru a preveni orice influență a câmpurilor electrice exterioare mediului de cultură. Monitorizarea continuă a câmpului a fost făcută prin măsurarea căderii de potențial pe o rezistență de 100 ? plastaa în serie cu unul dintre firele cu ajutorul căruia se genera câmpul. Voltajul pe această rezistență a fost corelat liniar cu intensitatea câmpului (r2=0,96). Pentru a verifica că cadrul experimental nu a fost expus niciunui câmp magnetic semnificativ, a fost măsurată radiația electromagnetică în vecinătatea imediată a culturilor tratate, folosind o antenă (EMCO6507 1kHz–30 MHz) conectată la un analizator de spectru (Anritsu 9kHz–2,2 GHz). Radiația electromagnetică în domeniul 100-300 kHz în incubatoarele conținând cutiile cu culturile de celule tratate a fost de 10-12 Tesla și în cuștile unde erau cobaii tratați cu TTF a fost de 10-14 Tesla, adică neglijabilă.
Simulările distribuției câmpului electric prin metoda elementelor finite
Evaluările câmpului electric la nivelul celulelor sunt bazate pe metoda elementelor finite, folosind o descriere simplificată a morfologiei celulei (vezi fig. 7). În toate calculele, constanta dielectrică atât a citoplasmei, cât și a mediului a fost de 80, conductanța de 0,3 S/m, diametrul celulei a fost de 10 µm și grosimea membranei a fost de 3 nm (cu o constantă dielectrică de 3). Intensitatea câmpului electric a fost cartografiată la nivelul celulei, pe baza amplitudinii (1 V/cm), frecvenței (100 kHz) și a formei de undă (sinus) a câmpului electric aplicat culturii de celule. Forța exercitată de un câmp neomogen, precum cel creat înăuntrul celulelor în cazul unui singur dimer de tubulină, a fost calculată pe baza interacțiunii directe dintre câmpul electric și dipol. Astfel, forța care acționează asupra unei particule polarizabile va acționa totdeauna în direcția convergenței liniilor de câmp electric. Viteza finală a particulelor, datorată acestor forțe, a fost calculată folosind legea lui Stoke.
Cadrul experimental in vivo
Tratamentul cu TTF a fost aplicat cu ajutorul a două perechi de fire de 10 mm lungime, paralele și izolate (cu diametrul exterior de 0,5 mm; grosimea izolației de 0,125 mm; Tefzel) plasate intradermic pe spatele unui cobai. O altă pereche identică de fire a fost plasată paralel cu prima pereche la fiecare cobai, cu un spațiu de 5 mm între perechile de fire. Liniile de celule (4 µl; 3×105 celule) au fost injectate intradermic între firele de la fiecare pereche de fire implantate. Apoi, doar o singură pereche de fire a fost conectată la un amplificator de tensiune pentru a aplica tratamentul cu TTF de 100 kHz la singură o tumoare. Cealaltă pereche de fire a fost lăsată neconectată și tumoarea dintre aceste fire a servit drept control pentru tumoarea tratată (vezi fig. 1B). Mărimea tumorii a fost calculată înmulțind lungimea maximă a tumorii cu lățimea maximă a ei.
Rezultate
Efectul câmpurilor TTF asupra celulelor din cultură
Au fost expuse câmpurilor TTF mai mult de 500 de cutii de cultură. Numărul celulelor din fiecare cutie tratată a fost calculat periodic, folosind determinarea colorimetrică (cum a fost descris în “Materiale și metode”). Datorită faptului că au fost în condiții de control, majoritatea liniilor de celule au avut timpuri de dublare mai mici de 24 de ore (între 17 și 24 ore; cu excepția PC-3, care a avut timpul de dublare de 73 de ore), durata tratamentului a fost de cel puțin 24 de ore. Expunerea a început la 24 de ore după însămânțare și a fost continuată până la 72 de ore. În toate liniile de celule testate, 24 de ore de expunere la TTF de 100 kHz (cu o intensitate de 1,0–1,4 V/cm) au provocat o inhibare semnificativă a proliferării celulelor (domeniul TER 0,14–0,96; P<0,05; fig. 1C). Acest efect s-a resimțit și după timpul de expunere a celulelor la câmpurile TTF. De fapt, în anumite experimente (de exemplu în melanomul malign), creșterea culturii a fost oprită până 72 de ore după ce expunerea la TTF a fost terminată (fig. 2A).
S-a verificat dacă culturile și țesuturile nonreplicative sunt afectate de câmpurile TTF. Culturile BHK au fost menținute în condiții cu ser scăzut (0,1% FCS) pentru a reduce rata lor de replicare. Apoi, aceste culturi au fost expuse la câmpuri de 100 kHz (la o intensitate de 1,2 V/cm) timp de 24 de ore. În aceste condiții, nu s-a observat nicio diferență semnificativă (P=0,97) în numărul de celule între culturile de control și culturile tratate cu câmpuri TTF. După revenirea acestor culturi la mediul normal de cultură (10% FCS), replicarea normală a reînceput atât în culturile expuse câmpurilor TTF, cât și în culturile de control. De asemenea, a fost testat efectul tratamentului cu TTF asupra numărului de celule viabile în țesuturile nonreplicative prelevate de la șobolani. Astfel, au fost expuse câmpurilor TTF de 100 kHz patru segmente din intestinul șobolanului și patru segmente din diafragmă, la o intensitate de 1,2 V/cm timp de 24 de ore. Nu s-au observat diferențe între numărul celulelor viabile în cazul ambelor tipuri de țesuturi tratate, comparativ cu țesuturile de control (intestin, P=0,3; diafragmă, P=0,54).
Pentru a testa relația dintre intensitatea câmpului TTF și inhibarea proliferării celulelor, liniile de celule de melanom la cobai (B16F1) și gliom la șobolan (F-98) au fost expuse la câmpuri TTF de diferite intensități între 1 si 2,5 V/cm. Efectul inhibitor al câmpurilor TTF asupra proliferării celulelor a crescut odată cu intensitatea (fig. 2B), până ce proliferarea a fost oprită complet la intensități de 1,4 și 2,25 V/cm la nivelul celulelor de melanom și, respectiv, de gliom. Se pare că efectele câmpurilor TTF sunt dependente de frecvență, datorită dependenței de frecvență a impedanței electrice a membranei (datorită capacității membranei). Aceste schimbări ale impedanței fac ca fracțiunea de câmp ce pătrunde celulele să fie funcție de frecvență. Așadar, a fost testată dependența de frecvență a efectului inhibitor al câmpurilor TTF asupra ratei de creștere a celulelor de melanom (B16F1) și de gliom (F-98). S-a realizat o comparație între eficiența câmpurilor TTF la diferite frecvențe. După cum se vede în fig. 2C, efectul inhibitor al câmpurilor TTF a fost dependent de frecvență. Este interesant faptul că frecvența la care s-a atins inhibarea maximă a fost diferită pentru cele două tipuri de celule (120 kHz pentru melanom și, respectiv, 200 kHz pentru gliom).
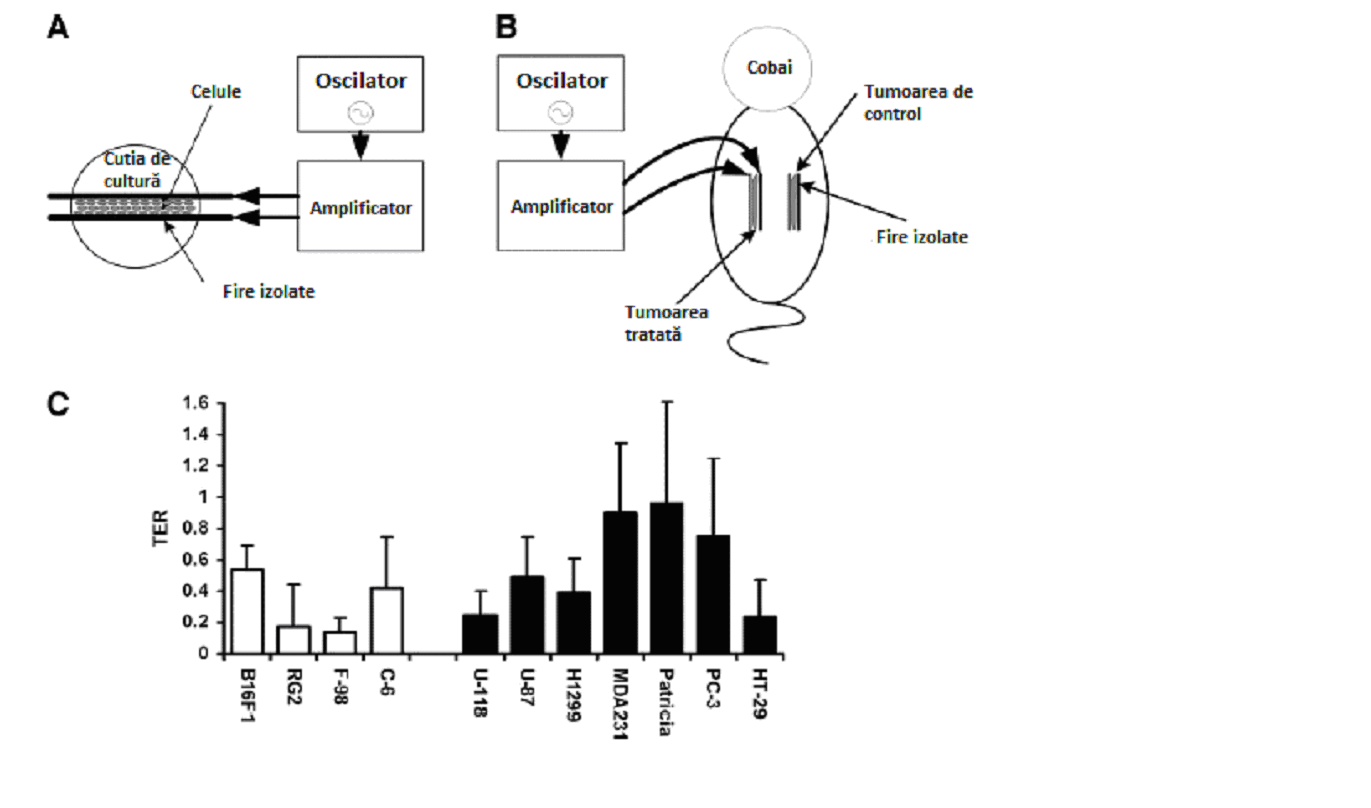
Fig. 1 Reprezentările schematice ale condițiilor experimentale in vitro (A) și in vivo (B). C, câmpurile TTF inhibă creșterea liniilor de celule canceroase in vitro. Culturile au fost expuse la TTF de 100 kHz cu o intensitate de 1–1,4 V/cm. TER, adică raportul dintre scăderea ratei de proliferare a celulelor tratate și rata de proliferare a celulelor de control [(GRc-GRt)/GRc]. În toate cele patru linii de celule animale (£) și cele șapte linii de celule umane (¢) testate, raportul este mai mare ca 0, indicând o inhibare în rata de proliferare a culturilor de celule tratate, față de culturile de control aflate la aceeași temperatură. Toate efectele au fost semnificative din punct de vedere statistic (P<0,05; testul t al Studentului).
Efectele câmpurilor TTF asupra proceselor celulare și moleculare care au loc în celulele care proliferează
Pentru a desluși procesele celulare prin care câmpurile TTF afectează proliferarea celulelor a fost realizată microfotografierea pe o perioadă mai mare de timp, pe durata aplicării TTF culturilor de celule de melanom la cobai. Astfel, au devenit evidente mai multe procese importante. Fenomenul cel mai pronunțat a fost prelungirea mitozei. În celulele tratate, mitoza părea să înceapă normal, dar a fost prelungită pe durate variabile de timp înainte de sfârșitul scindării în două celule fiică. Fig. 3A ilustrează un proces exemplar de mitoză la nivelul unei celule tratate cu TTF. Dupa cum se poate vedea, mitoza nu a fost completă în 3 ore. Datorită acestei opriri a proliferării, la nivelul culturilor tratate mitoza a durat în medie 124 ± 91 minute, în vreme ce în condițiile de control mitoza a durat în medie 62 ± 8 minute de la rotunjirea celulei la citokineză. Această prelungire a timpului de mitoză este semnificativă din punct de vedere statistic (P<0,01; testul U Mann-Whitney).
Al doilea fenomen major observat în celulele de melanom tratate cu TTF a fost că un sfert din celulele care erau în mitoză erau distruse atunci când formarea liniei de clivaj se apropia de separarea completă a celor două celule. În timpul acestui proces, membrana celulară s-a rupt și s-au format mai multe umflături ale membranei, semănând cu moartea celulară prin apoptoză, post-mitotică. Două celule exemplare care suferă acest proces de distrugere sunt prezentate în fig. 3B și C. Efectele distructive au fost observate doar la nivelul celulelor mitotice, în vreme ce celulele care nu se divizau au rămas intacte din punct de vedere morfologic și funcțional.
Al treilea fenomen, observat numai la nivelul culturilor de celule tratate cu TTF, a fost rotația nucleară. În mitoza timpurie, după rotunjirea celulei, nucleul putea fi văzut rotindu-se în celulă. O rotație completă a durat în medie 15 minute. Acest efect seamănă cu rotația întregii celule descrisă anterior în timpul expunerii la câmpuri electrice alternative de frecvență intermediară.
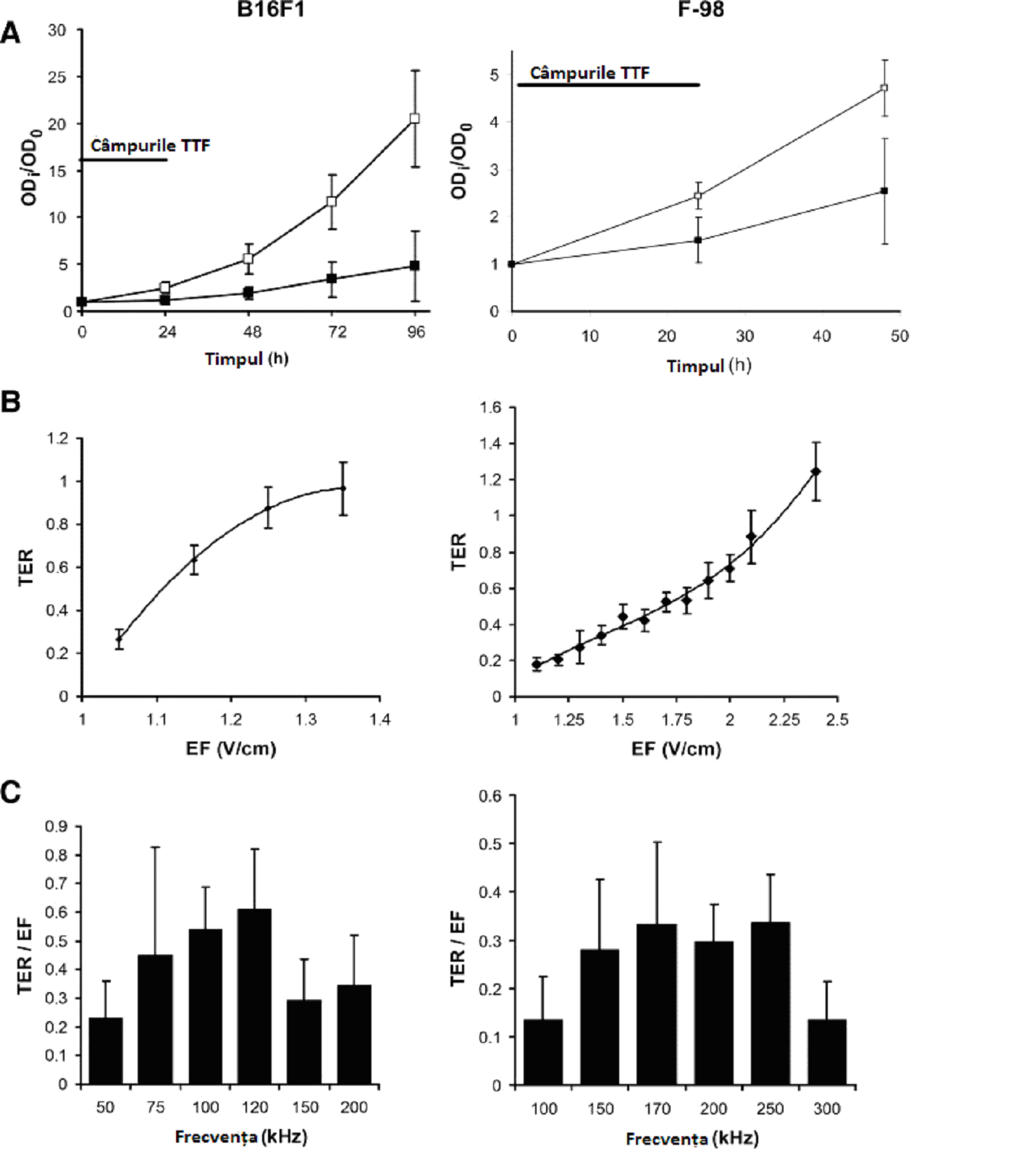
Fig. 2 Dependența de timp, frecvența câmpului și intensitate a efectului TTF asupra proliferării celulelor maligne de melanom (B16F1, coloana din stânga) și de gliom (F-98, coloana din dreapta). A, numărul de celule în culturile netratate (de control £) comparativ cu culturile tratate cu câmpuri TTF (¢). Numărul de celule în fiecare punct temporal (ODi) a fost raportat la numărul de celule din cultură înainte de începerea tratamentului (OD0). Se vede că numărul celulelor de control aproximativ se dublează la fiecare 24 de ore pe parcursul experimentului. TTF au fost aplicate timp de 24 de ore în continuu (liniile solide) la o frecvență de 100 kHz în cazul culturilor de celule de melanom și la o frecvență de 200 kHz în cazul culturilor de celule de gliom. Creșterea în timp a numărului de celule tratate de melanom (stânga) și de gliom (dreapta) este semnificativ mai redusă decât în cazul celulelor de control (P<0,001). B, Efectul expunerii timp de 24 de ore la câmpuri TTF de intensități tot mai mari. Amploarea efectului este exprimată cu ajutorul TER. Astfel, efectul inhibitor al TTF asupra proliferării crește odată cu creșterea intensității în cazul ambelor tipuri de celule. Oprirea completă a proliferării (TER=1) este observată la 1,35 și 2,25 V/cm în cazul celulelor de melanom, respectiv, de gliom. EF, câmpul electric. C, schimbarea în rata de creștere a celulelor de melanom (stânga) și de gliom (dreapta) după 24 de ore de expunere la TTF de diferite frecvențe este raportată la intensitatea câmpului (TER/EF). Este observat un efect de fereastră cu inhibare maximă produsă de TTF la 120 kHz în cazul celulelor de melanom și la ~200 kHz în cazul celulelor de gliom.
O caracteristică fundamentală a câmpurilor electrice este că în orice punct din spațiu ele au o orientare definită, corespunzând direcției forței pe care aceste câmpuri o exercită asupra sarcinilor și asupra elementelor polare. În ceea ce privește pe acestea din urmă, forța exercitată de câmp este maximă atunci când dipolul este orientat pe direcția câmpului. Astfel, sunt două mari diferențe structurale între celulele care nu se divid și cele care se divid. O diferență este că celulele care se divid conțin microtubuli bine polarizați, orientați spațial, care dezvoltă o morfologie directională, în formă de sticlă de ceas, a celulei în timpul fazei de citokineză. Tinând cont de aceste lucruri, ne-am putea aștepta ca forțele câmpului electric să aibă un efect maxim asupra procesului de mitoză atunci când este orientat de-a lungul liniilor de forță ale câmpului. Pentru a investiga acest aspect, culturile de celule de melanom au fost fixate și au fost colorate cu albastru de toluidină, imediat după 24 de ore de tratament cu TTF, pentru a demonstra mitozele și pentru a distinge celulele viabile de cele moarte sau deteriorate. Celulele viabile si cele mitotice deteriorate (în momentul fixării) au fost grupate conform cu orientarea axei lor de clivaj raportată la direcția câmpului electric. Celulele au fost numărate separat în fiecare din cele patru sectoare egale care formează unghiuri de 0°, 45° (două sectoare, 45 și 135) și 90° raportat la direcția câmpului. Astfel, după cum se poate observa din fig. 4, celulele viabile au fost distribuite aleatoriu în toate cele patru sectoare. În contrast, o proporție mult mai mare de celule deteriorate au avut axa de diviziune orientată de-a lungul câmpului: 56% la 0° versus o medie de 15% în toate celelalte orientări. În mod surprinzător, numărul de celule pe unitatea de suprafață în două sectoare de 45° a fost egal cu jumătate din numărul de celule pe unitatea de suprafață din sectorul 0°. Acest rezultat poate servi ca indicație pentru un efect adițional al TTF: orientarea diviziunii celulare pe direcția câmpului. Celulele din fiecare grup definit mai sus, spațial orientat, au fost apoi împărțite după stadiile mitozei în momentul fixării. În toate stadiile, o parte importantă din celulele deteriorate au avut axa de diviziune orientată în lungul campului. Mai mult, 74% din celulele orientate paralel cu liniile câmpului erau deteriorate în momentul metafazei (fig. 4B).
Axul mitotic, spațial organizat, care se formează la nivelul celulelor care se divid, constă din microtubuli care au momente electrice dipolare foarte mari și, astfel, pot fi dezorientate de către forțele câmpurilor electrice. Filamentele de actină sunt, de asemenea, polare; totuși, ele nu au vreo orientare spațială definită la nivelul celulei și, astfel, nu sunt afectate semnificativ de câmpurile electrice. Acest fapt ne-a determinat să testăm dacă TTF deteriorează procesul de mitoză prin interferența cu formarea normală, cu orientarea și cu mișcarea microtubulilor, comparativ cu filamentele de actină, după cum urmează: Culturile de celule de melanom au fost tratate timp de 24 de ore cu TTF. După tratament, celulele au fost fixate, colorate cu anticorpi monoclonali împotriva microtubulilor și a filamentelor de actină, precum și pentru ADN și, apoi, aceste celule au fost studiate cu ajutorul microscopiei cu fluorescență. În culturile de control, 95% din celulele care treceau prin mitoză au prezentat stadiile normale ale mitozei cu axe mitotice intacte. Pe de altă parte, în cazul culturilor tratate cu TTF, mai mult de jumătate din mitoze au fost anormale.
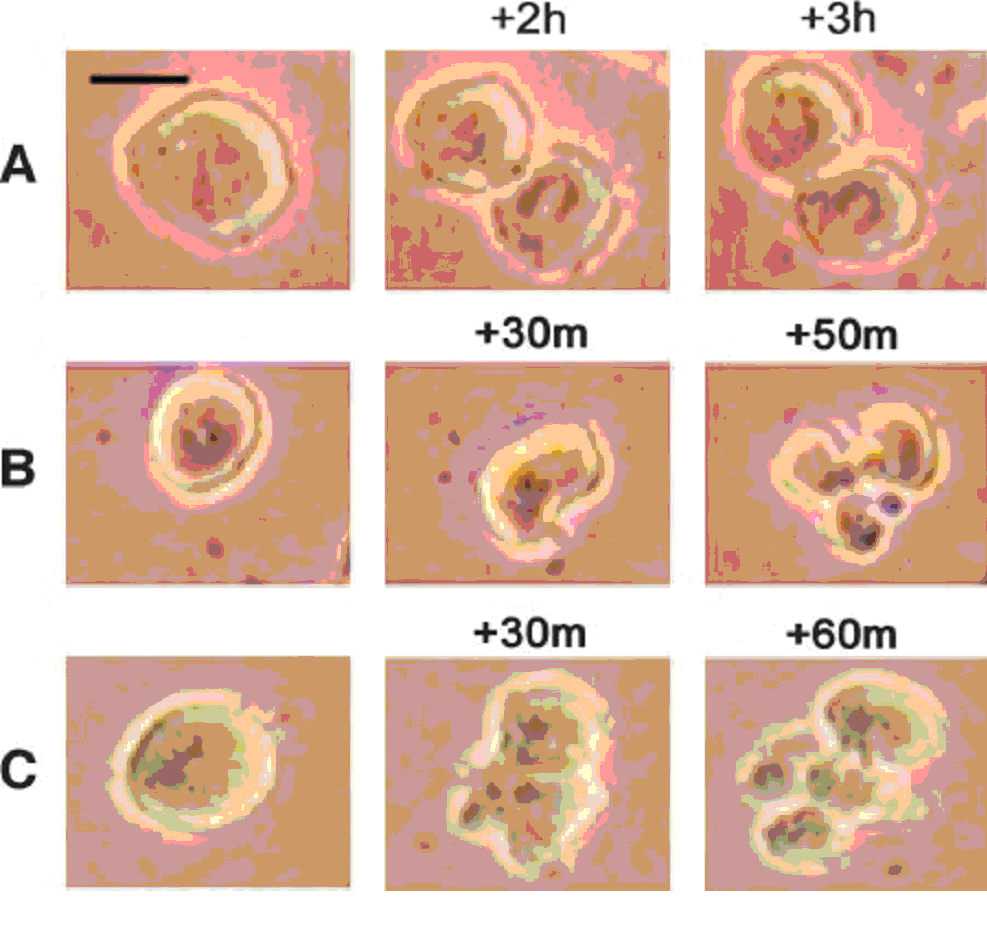
Fig. 3 Microfotografie în timp a celulelor maligne de melanom expuse câmpurilor TTF. A, un exemplu de celulă în mitoza oprită de TTF. Contrar mitozei normale, a cărei durată este mai mică de o oră, celula din imagine rămâne staționară la mijlocul citokinezei, timp de 3 ore. B și C, două exemple de dezintegrare a unor celule tratate cu TTF în timpul citokinezei. Sunt prezentate trei stadii consecutive: rotunjirea celulei (stânga); formarea liniei de clivaj (mijloc); și dezintegrarea celulei (dreapta). Scara 10 µm.
Fig. 5 arată exemple de diferite forme de mitoză anormală, observate sub tratamentul cu TTF. Acestea au inclus celule polipoide în profază, celule prost separate, celule cu mai multe axe și celule cu un singur ax în metafază, anafaze asimetrice și o mare proporție de celule în metafază (>20%), cu ansambluri de cromozomi în formă de rozetă. Stadiile normale și anormale ale mitozei în cazul culturilor de control și al culturilor tratate cu TTF sunt prezentate și comparate în fig. 5G. În general, aceste anomalii pot servi ca o indicație a interferenței câmpurilor TTF cu comportamentul normal al microtubulilor. În contrast, colorarea filamentelor de actină nu a evidențiat nicio diferență între culturile tratate cu TTF și culturile de control.
Efectele câmpurilor TTF asupra tumorilor in vivo
Pentru a testa dacă câmpurile TTF sunt eficiente pentru distrugerea celulelor tumorale in vivo, am testat efectul lor pe două modele tumorale animale: cobai C57BL/6 inoculat intradermic cu celule maligne de melanom (B16F1) și cobai BALAB/c inoculat cu celule de adenocarcinom (CT-26). Câmpurile TTF au fost generate între firele izolate complet, implantate intradermic de ambele părți ale tumorei (vezi fig. 1B). Cobaii cu electrozi implantați au fost tratați 3–6 zile în continuu, la o zi după inocularea liniei de celule. Astfel, câmpurile TTF de 100-200 kHz de intensitate mică, <2 V/cm, au inhibat eficient creșterea melanomului malign, comparativ cu creșterea tumorilor de control netratate. În fig. 6 sunt prezentate pentru comparație fotografii cu tumorile maligne de melanom tratate și netratate. Tumorile tratate au fost semnificativ mai reduse ca dimensiune la sfârșitul tratamentului (dimensiunea medie a tumorii tratate a fost de 47% din dimensiunea tumorii de control; n=78 cobai, P<0,001; testul t al Studentului). Analiza histopatologică a tumorilor tratate a dovedit existența masivă a necrozei cu resturi rezultate prin karyorrhexis și karyolysis (fig. 6F). Pentru a testa dacă câmpurile TTF sunt eficiente în tratarea diferitelor tipuri de tumori, cobaii BALAB/c cu adenocarcinom intradermic au fost tratați cu aceiași parametri ai câmpului. În fig. 6B sunt prezentate, pentru comparație, fotografii care ilustrează tumori de adenocarcinom tratate și netratate. Efectul mediu al câmpurilor TTF asupra cobailor cu adenocarcinom a fost mai puțin dramatic decât efectul observat asupra melanomului malign (dimensiunea medie a tumorii tratate a fost 73% din dimenisunea tumorii de control la sfârșitul tratamentului; n=14 cobai). După tratament, tumorile și țesuturile lor adiacente au fost fixate, colorate și H&E și analizate din punct de vedere histopatologic. Nu s-a observat nicio deteriorare la nivelul țesuturilor înconjurătoare.
Discuție
În acest studiu s-a arătat faptul că, atunci când sunt potrivit alese, câmpurile electrice de frecvență intermediară, de foarte mică intensitate (TTF) au oprit creșterea celulelor canceroase. Acest efect inhibitor a fost demonstrat la nivelul tuturor tipurilor de celule proliferative testate, în vreme ce celulele și țesuturile neproliferative au rămas neafectate de aceste câmpuri. Un fapt interesant este că, în ceea ce privește inhibarea proliferării diferitelor tipuri de celule canceroase, aceasta a prezentat o dependență de intensitatea și frecvența specifică a câmpurilor TTF. S-a demonstrat că în timpul expunerii la câmpuri TTF, au loc două procese majore la nivel celular: oprirea proliferării și distrugerea celulelor. S-a arătat că deteriorarea produsă de câmpurile TTF asupra acestor celule proliferative este dependentă de orientarea procesului de diviziune în raport cu vectorii de câmp, acest efect fiind astfel non-termic. Într-adevăr, măsurătorile de temperatură făcute în cutiile de cultură în timpul tratamentului și la nivelul pielii de deasupra tumorilor tratate in vivo nu au arătat nicio creștere semnificativă de temperatură, comparativ cu culturile de control sau cu cobaii de control. De asemenea, TTF au făcut ca celulele aflate în diviziune să se orienteze pe direcția câmpului aplicat într-un mod similar aceluia descris în cazul celulelor epiteliale de cornee expuse unor câmpuri electrice constante. La nivel subcelular s-a evidențiat faptul că TTF perturbă procesul normal de polimerizare-depolimerizare a microtubulilor în timpul mitozei. Într-adevăr, configurațiile mitotice anormale descrise, observate după expunerea la TTF sunt similare anomaliilor morfologice observate la celulele tratate cu agenți care interferează direct sau indirect cu polimerizarea microtubulilor (de ex. Taxol).
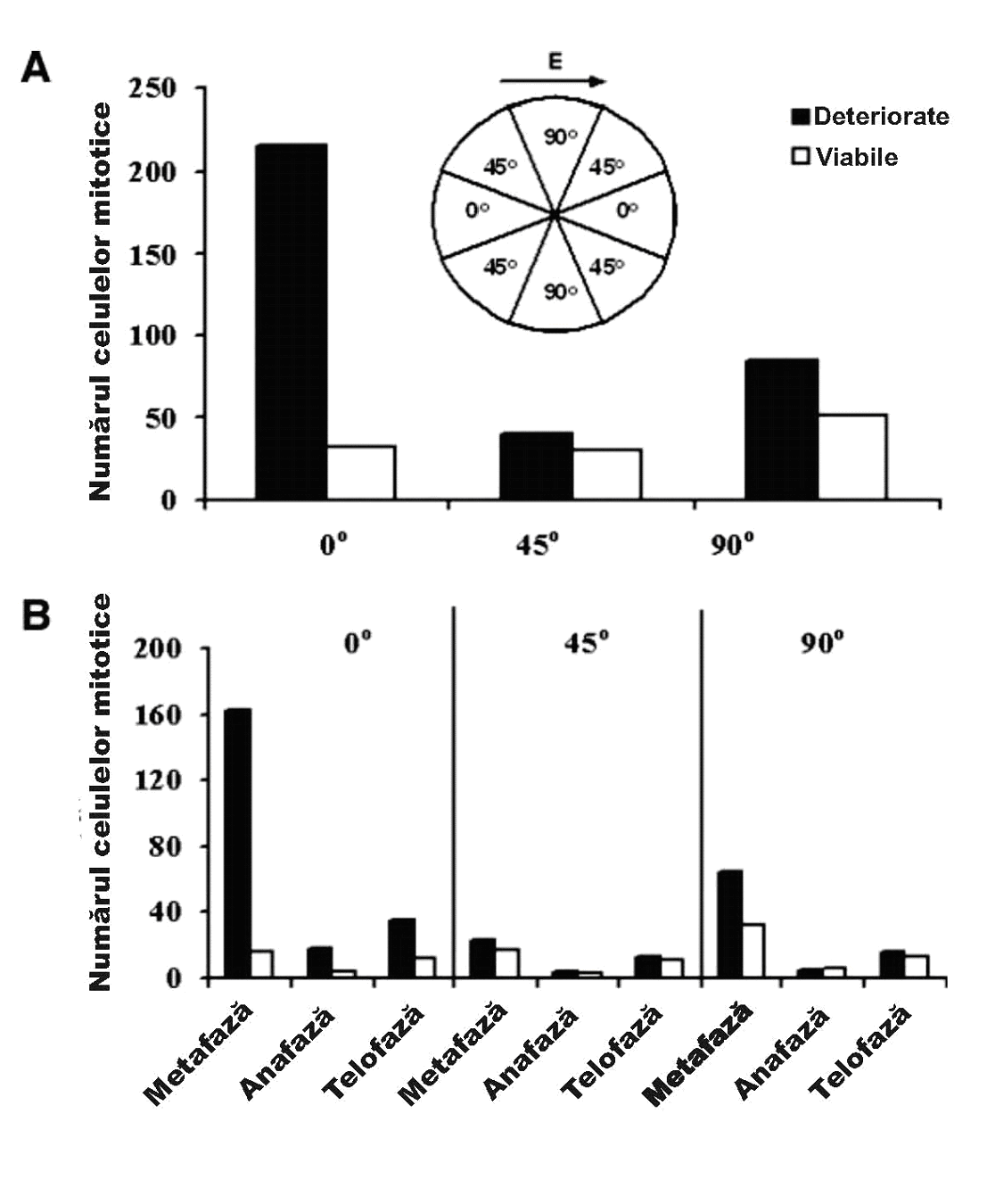
Fig. 4 Dependența deteriorării celulare indusă cu ajutorul TTF de orientarea axei de diviziune celulară față de direcția câmpului. Axa verticală reprezintă numărul de celule mitotice numărate în cazul a patru culturi de celule maligne tratate cu TTF la frecvența de 100 KHz. A, numărul total de celule mitotice deteriorate (¢) și viabile (£) în fiecare din cele trei sectoare cu unghiuri diferite față de direcția câmpului. Numărul celuleor deteriorate este mai mult de 5 ori mai mare decât numărul corespunzător de celule viabile atunci când diviziunea celulară este aliniată la sau aproape de 0° față de direcția câmpului electric. În sectoarele altor unghiuri, numărul celulelor deteriorate depășește doar cu puțin numărul celulelor viabile. De remarcat faptul că, deoarece aria de 45° este dublă față de cea a celorlalte două sectoare, numărul de celule prezente în această orientare a fost înjumătățit. B, senzitivitatea celulei aflată în procesul de diviziune față de câmpuri cu orientări diferite la diferite stadii ale mitozei. Atunci când axa de diviziune a celulei este aliniată la 0° față de câmpul electric, numărul de celule deteriorate (¢) este semnificativ mai mare decât numărul de celule intacte (£) în toate cele trei faze ale mitozei. Totuși, numărul cel mai mare de celule deteriorate în această orientare este observat la metafază (de 8 ori mai mare decât numărul celulelor intacte).
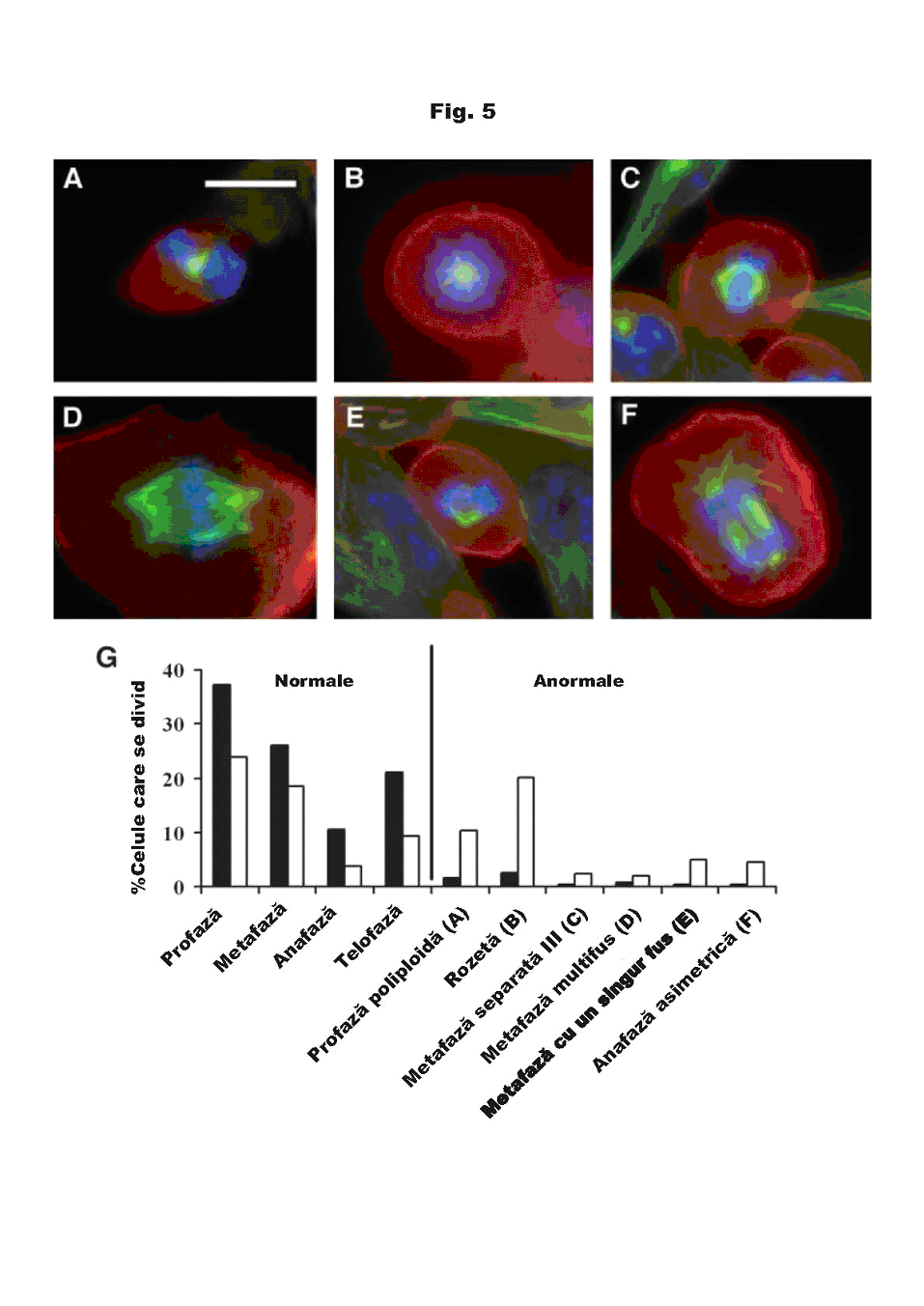
Fig. 5 Colorarea imunohistochimică a celulelor mitotice anormale din culturile de celule tratate cu TTF. Culturile de melanom malign (n=4) au fost tratate timp de 24 de ore la 100 kHz și apoi au fost colorate cu anticorpi monoclonali pentru microtubuli (verde), actină (roșu) și ADN (albastru). Microfotografiile prezintă mitoze anormale exemplare, incluzând: profaza poliploidă (A); rozeta (B); metafază prost separată (C); metafază multifus (D); metafază cu un singur fus (E); și anafază asimetrică (F). G, procentul celulelor mitotice tratate (£) și de control (¢) în fiecare din fazele normale și anormale ale mitozei.
Pentru a explica cum este posibil ca TTF să provoace deteriorarea dependentă de orientare la nivelul celulelor canceroase și să perturbe formarea corectă a axului mitotic, s-au modelat forțele exercitate de TTF asupra sarcinilor electrice intracelulare și asupra particulelor polare, cu ajutorul simulărilor prin metoda elementelor finite. Astfel, au fost identificate două mecanisme de bază prin care câmpurile electrice pot afecta celulele aflate în diviziune. Primul mecanism este în legătură cu efectul de câmp asupra orientării macromoleculei polare. În acest cadru, în timpul fazelor timpurii ale mitozei, adică în pre-telofaza, când procesul de polimerizare-depolimerizare la nivelul tubulinei conduce procesul de proliferare, câmpul electric forțează toți dimerii de tubulină, poziționați la o distanță mai mare de 14 nm de capătul aflat în creștere al unui microtubul, să se orienteze pe direcția câmpului. Acest moment al forței (10-5 pN) acționând asupra dimerilor este suficient pentru a interfera cu procesul normal de asamblare și dezasamblare a microtubulilor care este esențial pentru alinierea și separarea cromozomilor. Acest efect poate explica oprirea mitozei la nivelul celulelor tratate cu TTF. Al doilea mecanism care interferează cu diviziunea celulară și care se pare că joacă un rol important în distrugerea celulelor, devine dominant în timpul clivajului. După cum se vede în simulările prezentate în fig. 7B, câmpul electric la nivelul celulelor care nu se divid este omogen, în vreme ce câmpul la nivelul celulelor mitotice, în timpul citokinezei, nu este omogen. Observăm o concentrare a liniilor de câmp (indicând o creștere a intensității câmpului) la nivelul liniei de clivaj, un fenomen care seamănă foarte mult cu focalizarea unei raze de lumină cu ajutorul unei lentile. Această eterogenitate la nivelul intensității câmpului exercită o forță electrică unidirecțională asupra tuturor entităților intracelulare încărcate electric și polare, trăgându-le către linia de clivaj (indiferent de polaritatea câmpului). De exemplu, pentru o linie de clivaj care a atins un diametru de 1 µm într-un câmp exterior de numai 1 V/cm, forța exercitată asupra microtubulilor este de aproximativ 5 pN. Această mărime este compatibilă cu forțele necesare pentru a opri polimerizarea microtubulilor, acestea fiind de aproximativ 4,3 pN. În ceea ce privește celelalte particule, precum organitele citoplasmatice, acestea sunt polarizate de câmpul din celulele aflate în diviziune. Odată polarizate, forțele care acționează asupra acestor particule pot atinge valori de până la 60 pN, ceea ce conduce la mișcarea lor spre linia de clivaj cu viteze care se apropie de 0,03 µm/s. La o asemenea viteză, organitele citoplasmatice se îngrămădesc spre linia de clivaj în câteva minute, interferând cu procesul de citokineză și conducând foarte probabil la distrugerea celulei. S-a descoperit, de asemenea, că forțele electrice care acționează asupra particulelor intracelulare sunt maxime atunci când axa de diviziune celulară este aliniată cu câmpul exterior. Aceasta este în concordanță cu dependența efectului distructiv al TTF de unghiul dintre axa de diviziune celulară și câmpul electric (fig. 4). În plus, dependența calculată a magnitudinii acestei forțe de frecvență este în acord cu dependența de frecvență determinată experimental a efectului inhibitor al TTF asupra proliferării celulelor de melanom și de gliom (fig. 2C).
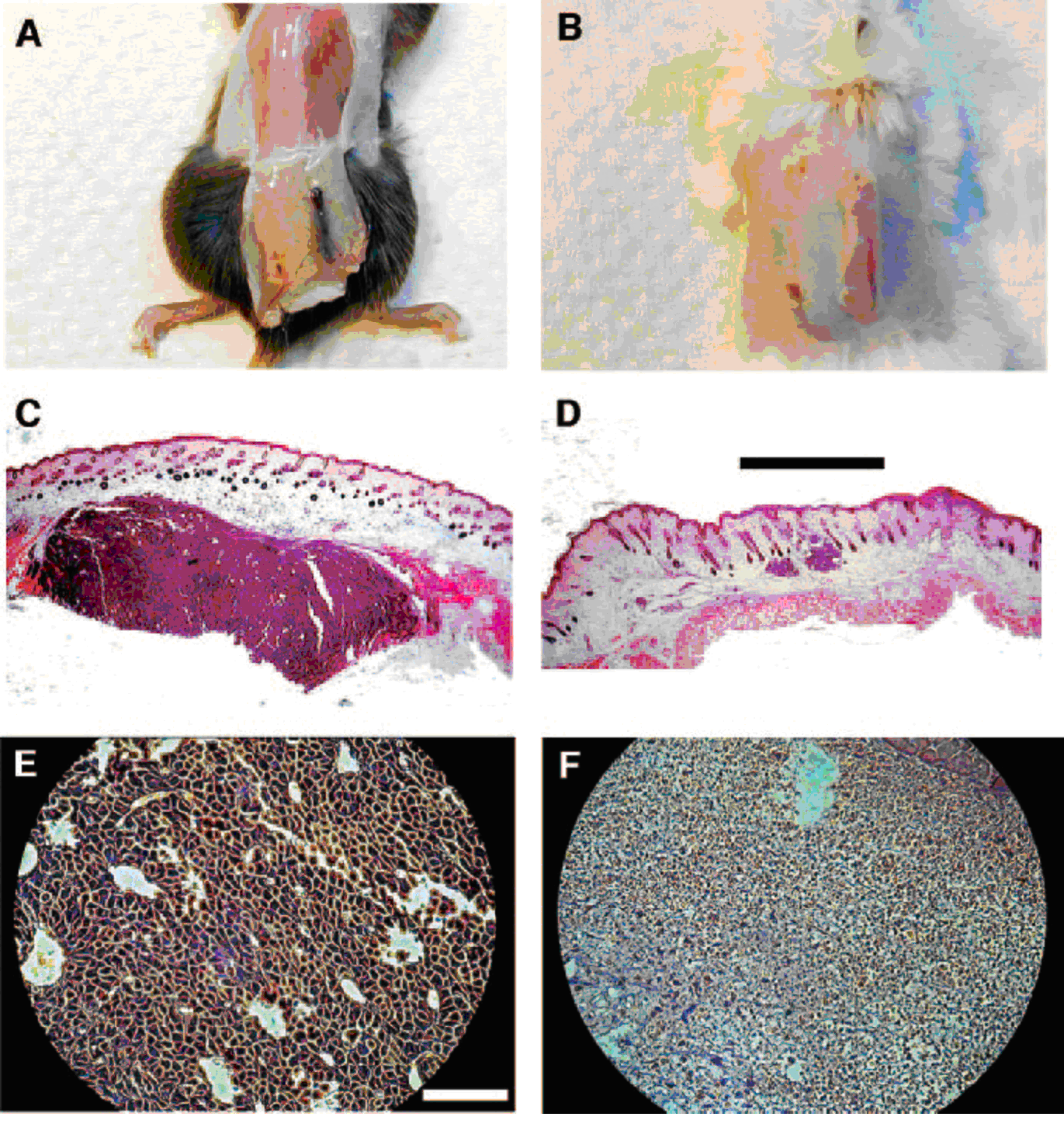
Fig. 6 Efectele in vivo ale TTF asupra tumorilor intradermice la cobai. Celulele tumorale de melanom malign (A) și de adenocarcinom (B) au fost injectate intradermic în două locații paralele, situate pe spatele fiecărui cobai. A fost tratată doar tumoarea din partea stângă a cobaiului. După patru zile de tratament cu TTF (la 100 kHz), nu mai poate fi detectată nicio tumoare în locul tratat, în vreme ce în locul netratat a crescut o tumoare mare. C-F, secțiuni histologice ale melanomului intradermic tratat cu TTF versus melanomul de control (netratat) în cazul aceluiași cobai. C, după colorarea cu H&E, poate fi observat un nodul mare (5 mm diametru) de celule de melanom la nivelul dermei tumorii de control (×40). De remarcat că, datorită dimensiunii mari a tumorii, porțiunea sa din profunzime a fost pierdută în procesul pregătirii pentru observare. D, tumoarea tratată; sunt prezenți doar doi noduli mici (<0,4 mm diametru, scara de 0,5 mm). Structurile netumorale ale dermei sunt intacte din punct de vedere morfologic. E, tumoarea de control, celulele de melanom malign apar intacte și viabile (×200) (scara 100 µm). F, la nivelul tumorii tratate se observă doar țesut necrozat și resturi celulare.
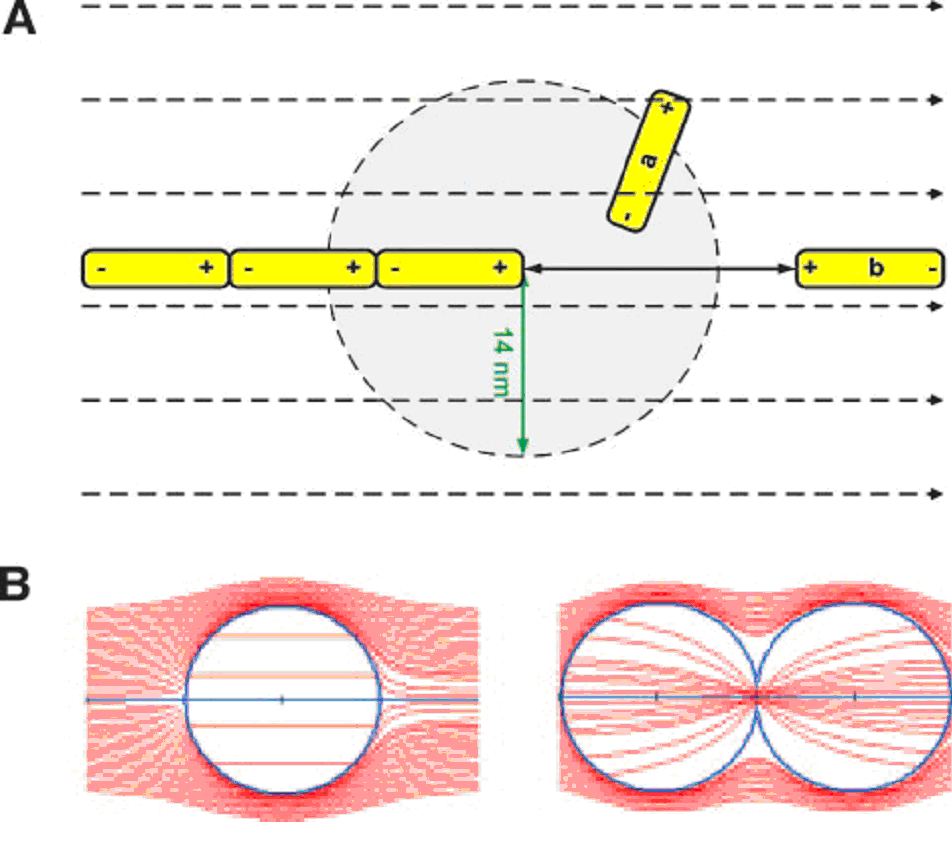
Fig. 7 A, Reprezentarea schematică a doi dimeri de tubulină poziționați lângă vârful unui microtubul care se alungește într-o celulă aflată în procesul de diviziune. Forța pe care o exercită un TTF extracelular de 1V/cm asupra unui dimer de tubulină localizat la mai puțin de 14 nm de microtubulul (a) este mai mică decât forța exercitată de către vârful microtubulului polar și, așadar, acest dimer se va alinia după câmpul generat de microtubul. În contrast, dimerii aflați la o distanță mai mare de 14 nm față de capătul microtubulului (b) sunt aliniați de forțele TTF (liniile punctate) într-o direcție care poate să nu fie compatibilă cu procesul de polimerizare-depolimerizare. B, simularea liniilor de forță ale câmpului electric în interiorul unei celule care nu se divide (stânga) și în interiorul unei celule care este în procesul mitotic de citokineză (dreapta), folosind metoda elementelor finite. Diametrele celulelor în simulare au fost de 10 µm și grosimea membranei de 3 nm. Înăuntrul celulei care nu se divide, câmpul electric este relativ uniform (distanțe egale între liniile de forță). În contrast, în cazul celulei aflate în diviziune celulară, câmpul este neomogen–intensitatea câmpului (densitatea liniilor) crește către linia de clivaj.
În concluzie, a fost demonstrat faptul că TTF inhibă atât proliferarea celulelor maligne din cultura de celule, cât și creșterea tumorilor la cobai, fără a genera efecte secundare generale sau deteriorări histopatologice locale. Mecanismul acțiunii câmpurilor este, cel puțin în parte, dependent de deteriorarea microtubulilor axului mitotic și de forțele electrice care rezultă din focalizarea câmpului asupra celulelor care se divid. Efectele precise ale acestor câmpuri asupra celulelor care se divid, împreună cu relativa ușurință a aplicării acestor câmpuri, a focalizării lor și a ecranării lor, face din aceste câmpuri electrice un candidat atractiv care să servească drept nouă modalitate de tratament pentru pacienții bolnavi de cancer.





