sursa: Wikipedia
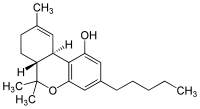
Tetrahidrocanabinol-ul (prescurtat THC), sau mai precis izomerul său principal, (6aR,10aR)-delta-9-tetrahydrocannabinol, este componenta psihoactivă principală conținută în Cannabis, fiind izolat pentru prima oară în 1964, în forma sa pură, de către savanții israelieni Raphael Mechoulam, Yechiel Gaoni, împreună cu colegii lor de la Universitatea din Ierusalim.
THC se prezintă sub forma unui solid sticlos, la temperaturi scăzute, devenind vîscos și lipicios la temperaturi ridicate, având aparența unei rășini. Fiind o terpenoidă aromatică, THC este foarte puțin solubil în apă, dar are o solubilitate ridicată în solvenți organici, precum lipidele și alcoolul, dar nu numai.
Se presupune că, precum mulți dintre metaboliții secundari cu acțiune farmacologică produși de plante, THC-ul are rol în sistemul de autoapărare împotriva ierbivorelor. Totodată, THC are proprietăți de absorbție a ultravioletelor din gama UV-B (280-315nm), din acest motiv speculându-se că ar putea contribui și la protejarea plantei de influența radiațiilor ultraviolete dăunătoare.
THC-ul, împreună cu izomerii lui, este unul dintre doar cei trei canabinoizi aflați pe lista Convenției Substanțelor Psihotropice (celelalte două fiind dimetilheptilpiran și parahexil).
Imaginea 3D a moleculei de THC Molecula de THC
Farmacocinetică și date fizico-chimice
|
Biodisponibilitate |
10–35% (inhalare), 6–20% (administrare orală) |
|
Cuplare la proteine |
97–99% |
|
Metabolism |
în cea mai mare parte hepatic, prin CYP2C |
|
Timp de înjumătățire |
1.6–59 h, 25–36 h (dronabinol administrat oral) |
|
Excreție |
65–80% fecală, 20–35% urinară, ca metaboliți acizi |
|
Masa moleculară |
314.4636 |
|
Punct de fierbere |
157 °C (315 °F) |
|
Solubilitate în apă |
0.0028 (23 °C) mg/mL (20 °C) |
|
Rotația specifică |
-152° (etanol) |
Farmacologie
Acțiunea farmacologică a THC rezultă din activitatea sa ca agonist parțial al receptorilor canabinoizi CB1 (la concentrații Ki=10nM), localizați în sistemul nervos central, și asupra receptorilor CB2 (la concentrații Ki=24nM), aflați în special în celulele sistemului imunitar. Efectul psihoactiv al THC-ului este mediat în principal de activarea receptorilor cuplați G-proteic (GPCR sau GPLR) tip CB1, fapt ce duce la scăderea concentrației de molecule mesager cAMP prin inhibarea adenilat-ciclazei.
Prezența acestor receptori specializați pentru canabinoizi în creier, a condus cercetătorii la descoperirea endocanabinoizilor, precum anandamida și 2-arahidonoil glicerida (2-AG). THC-ul activează receptorii respectivi într-o manieră mult mai puțin selectivă decât endocanabinoizii produși de către organism în timpul semnalizării inverse, deoarece molecula are o afinitate și o eficiență destul de scăzută în activarea acestor receptori. Acolo unde există o densitate scăzută a receptorilor endocanabinoizi, THC-ul poate acționa antagonic față de moleculele agoniste endogene, care posedă o eficiență mai ridicată de cuplare la receptorii respectivi.
Fiind o moleculă lipofilă, THC-ul se poate cupla în mod nespecific cu o varietate de receptori, atât din creier, cât și din restul corpului, precum țesutul adipos.
Unele studii au sugerat că THC are efect anticolinesterazic, el fiind astfel un tratament potențial pentru Alzheimer sau miastenie (Miastenia Gravis).
Efecte
THC-ul are efecte analgezice moderate, motiv pentru care cannabis-ul poate fi utilizat pentru tratarea durerilor, prin eliberării de neurotransmițători în ganglionii rădăcinii dorsale și în materia cenușie a coloanei vertebrale. Alte efecte sunt cel de relaxare, alterare a percepției vizuale, auditive, și olfactive, inducerea stării de oboseală, stimularea apetitului. THC-ul are de asemenea proprietăți antiemetice remarcabile, și poate reduce agresivitatea în unii subiecți.
Datorită activității sale agoniste parțiale, THC-ul pare să realizeze o sub-reglare mai intensă a receptorilor canabinoizi decât o fac endocanabinoizii, ceea ce îi limitează astfel eficiența. Chiar dacă efectele maxime ale unor medicamente pot fi limitate de către instalarea toleranței, s-a constatat că aceasta se dezvoltă neregulat, în funcție de efecte, existând o mai mare rezistență la instalarea toleranței în cazul efectelor principale și mai redusă în cazul efectelor secundare, ceea ce poate servi la îmbunătățirea ferestrei de acțiune a medicamentului respectiv.
În testele realizate pe șoareci, s-a constatat o reducere a fertilității, THC-ul blocând producerea de ATP în spermă.
La fel ca și alți canabinoizi, gruparea fenol conținută de către aceștia, fac ca THC să acționeze ca antioxidant, activitatea sa fiind suficientă pentru a proteja neuronii de stresul oxidativ, precum cel datorat excitotoxicității induse de glutamat.
Gustul și apetitul
Se cunoaște de multă vreme că unul dintre efectele THC-ului asupra ființelor umane este acela de creștere a apetitului. Mecanismul pentru această stimulare, se presupune că este un rezultat al activității din axa gastro-hipotalamică. Acțiunea receptorilor CB1 în centrii foamei din hipotalamus, face ca gustul alimentelor să fie mai plăcut, atunci când crește nivelul hormonului foamei, ghrelin, îninte de consumarea hranei. După ce hrana parțial digerată trece din stomac în duoden, sunt eliberați hormoni semnalizatori precum colecistochinina, și leptina, fiind astfel transmise semnale de sațietate hipotalamusului, activitatea canabinoizilor fiind astfel redusă.
Pe baza conexiunii între caracterul gustos al alimentelor și stimularea transmisiei de dopamină (DA) în scoarța Nacc (nucleus accumbens), s-a sugerat ca acțiunea cannabis-ului nu este doar aceea de a stimula gustul, ci și de a amplifica valoarea hedonică a alimentelor.
Această proprietate a fost dedusă pe baza unui test de reactivitate gustativă la șoareci, , în care s-a investigat influența THC-ului asupra secreției de DA în Nacc, după aplicarea unor soluții de sucroză sau chinină. Aplicarea THC-ului a crescut nivelul dopaminei, într-o manieră dependentă de doză, în cazul sucrozei, însă nu și în cazul chininei. Efectul a fost totodată cu atât mai ridicat cu cât soluția de sucroza a fost mai dulce, ceea ce a fost corelat cu asumpțiile cercetătorilor legate de caracterul hedonic al acțiunii THC-ului. Mecanismul care stă la baza acestui efect a fost elucidat cu ajutorul rimonabant-ului, un agonist invers al receptorului CB1, cunoscut pentru efectul său de limitare a apetitului pentru hrană sau dulciuri.
La aplicarea repetată a soluțiilor de sucroză însă, nu s-a mai constatat același nivel al secreției de DA, ceea ce arată că acest mecanism de răspuns suferă o acomodare în timp, ceea ce este inconsistent cu caracterul durabil al apetitului provocat de THC. Aceste observații sugerează că stimularea apetitului de către consumul de cannabis, nu este datorat doar amplificării caracterului gustos al alimentelor de către THC, ci și de către stimularea unor alte răspunsuri legate de apetit.
Reducerea efectelor
Efectele THC-ului pot fi reduse de către agoniștii inverși ai receptorului CB1, precum rimonabant-ul (SR1411716A), precum și de antagoniști ai receptorilor opioizi, cum ar fi naloxona și naloxazina. Antagonistul receptorului nicotinic alfa7, metilcaconitina, poate bloca autoadministrarea de THC în aceeași măsură în care vareniciclina poate afecta autoadministrarea nicotinei.
Canabidiolul, al doilea canabinoid ca abundență în cannabis, este un antagonist indirect al agoniștilor canabinoizi, el reducând astfel efectul agonist al THc-ului și anandamidei asupra receptorilor CB1 și CB2.
Toxicitate
Nu este documentat nici un caz de deces (uman) ca urmare a supradozării doar a THC-ului sau cannabic-ului, în formele lor naturale. Cazurile de deces notate în statistici, care au precizată prezența cannabis-ul sau THC-ul în analiza cazului, au ca și cauză un alt drog, adeseori cu o latență mult mai scăzută în organism. Totuși, THC-ul sintetic, cunoscut sub numele Marinol, a fost citat de FDA ca și cauză a patru decese între anii 1997 și 2005.
Informațiile privitoare la toxicitatea THC-ului sunt bazate în primul rând pe experiențele pe animale. Toxicitatea depinde semnificativ de calea de administrare și de specia animalului. Absorbția este limitată de saturația cu THC a lipidelor seroase, ceea ce duce la limitarea toxicității acestuia.
Studii realizate pe oameni
Aceste studii vor fi prezentate în secțiunea corespunzătoare. Totuși, ca un sumar, să notăm că prin administrarea de THC s-a constatat atenuarea simptomelor bolnavilor de cancer, aflați sub chimioterapie, precum și a bolnavilor de SIDA, prin creșterea poftei de mâncare și reducerea stărilor de greață. Totodată, un alt efect este reducerea presiunii intraoculare la pacienții suferind de glaucom. În plus, el utilizat în forma sa naturala, de cannabis, de către bolnavi de scleroză multiplă, pentru reducerea durerilor și spasticității, fiind în curs studii în această direcție, îngreunate de sistemul legislativ privind cannabis-ul și subprodusele sale.
În august 2009, Centrul Medical Hadasah, din Ierusalim, a efectuat un studiu clinic (faza IV) asupra efectelor THC-ului asupra sindromului de stres post-traumatic.
Utilizarea canabinoizilor sintetici (dronabinol) penru tratarea sindromului Tourette nu este încă foarte concludentă ca efete, dar există relatări despre utilizarea cu cu succes în astfel de cazuri a cannabis-ului.
În 1981, într-un studiu controlat placebo, dublu-orb, s-a administrat THC unui grup de pacienți suferind de scleroză multiplă. S-a constatat o scădere a spasticității, comparativ cu grupul placebo. Un efect similar s-a obținut și în cazul unui studiu simplu orb, controlat placebo, din 1983, când s-au obținut rezultate pozitive la 25% dintre pacienți.
Un număr de studii au fost realizate și prin administrarea de THC la pacienți cu leziuni ale coloanei vertebrale. S-a constatat scăderea spasticității la 2/5 dintre pacienții unui studiu încrucișat dublu orb, controlat placebo, realizat în 1986, și scădera spasticității și a durerilor, într-un studiu dublu orb, controlat placebo, realizat în 1990.
THC-ul poate constitui de asemenea un tratament efectiv pentru cancer, studii demonstrând reducerea tumorilor, într-un studiu pilot realizat asupra bolnavilor de glioblastoma multiformă (un tip de cancer care afectează creierul).
Studii realizate in vitro și pe animale
Și aceste studii vor fi prezentate în amănunt în secțiunea corespunzătoare, însă vom prezenta în continuare un sumar a acestora.
Astfel, s-a ajuns la concluzia că THC-ul poate preveni apariția Alzheimerului, în modelele animale, prin prevenirea inflamării cauzate de celulele microgliale, activate de către proteinele amiloide. În 2006, cercetătorii de la Institutul de Cercetări Scripps, utilizând atât modelarea pe calculator cât și teste biochimice, au ajuns la concluzia că THC-ul ar putea avea un rol terapeutic important în cazul Alzheimer-ului, prin tratarea simultană a simptomelor și progresiei bolii. Ei au observat că THC-ul inhibă formarea plăcii amiloide, principlul marker al acestei boli, fiind considerabil mai eficient decât două dintre medicamentele cele mai eficiente aflate pe piață, donepezil și tacrin.
THC-ul poate constitui de asemenea un tratament efectiv pentru cancer, studii demonstrând reducerea tumorilor la șoarecii de laborator fiind realizate în 1975 și 2007.
Un studiu realizat timp de doi ani pe șoareci și șobolani, care au fost hrăniți forțat cu THC, a avut ca rezultat reducerea masei corporale, rate de supraviețuire crescute, scăderea încidenței tumorilor, în special în cazul anumitor organe (în special cele aflate sub control hormonal). Totodată, administrarea a avut ca efecte atrofierea testiculelor, hipoplazie ovariană și uterină, precum și hiperactivitate și convulsii imediat după administrare, frecvența și apariția acestora fiind dependentă de doza administrată.
Alte cercetări realizate pe șoareci, au arătat că THC-ul previne stresul oxidativ indus de către peroxizii organici, la fel sau chiar mai bine decât alți antioxidanți, atât în sisteme chimice (reacție Fenton) cât și în culturi neuronale. Doze scăzute de THC, administrate șoarecilor, au redus progresul aterosclerozei.
Cercetătorii au demonstrat că referirile realizate în trecut la daunele cerebrale produse de cannabis nu sunt susținute științific, în ciuda efectelor colaterale pe care THC-ul le are. Mai mult, cercetările realizate pe canabinoizi sintetici, au arătat ca activarea receptorilor CB1 poate induce neurogeneza, precum și neuroprotecția, și pot chiar ajuta la prevenirea pe cale naturală a degradării neuronale datorate bolilor neurodegenerative, precum scleroza multiplă, Alzheimer sau Parkinson. Aceste cercetări, împreună cu cele realizate asupra receptorilor CB2 (din sistemul imunitar), au făcut ca suportul pentru utilizarea medicală a cannabis-ului să crească foarte mult, THC-ul fiind un agonist al ambilor receptori, CB1 și CB2.
Studii științifice privind efectele secundare
Unele studii subliniază apariția unui număr de efecte negative asociate cu utilizarea timp îndelungat, incluzând deprecierea memoriei de termen scurt. Utilizând tehnologia de scanare prin emisie de pozitroni (PET), un astfel de studiu arată modificarea funcțiilor memoriei, având ca rezultat o sporire a capacității de memorare cu 23 % a sfârșitului unei liste, dar totodată o scădere cu 19% a mijlocului unei liste care trebuia memorată, în cazul utilizatorilor cronici de cannabis.
Alte studii au sugerat că în cazul utilizatorilor de cannabis, există un risc mai ridicat de dezvoltare a psihozelor decât în cazul celor care nu îl utilizează. Acest risc pare să fie mai accentuat în cazul celor deja dispuși la psihoze, înainte de începerea utilizării cannabis-ului.
Un studiu realizat în Germania în 2008, a raportat cannabis-ulca factor declanșator al schizofreniei. Cu toate acestea, deși consumul de cannabis a crescut dramatic în unele țări pe parcursul ultimelor decenii, procentajul persoanelor cu această afecțiune nu a crescut, ceea ce aruncă îndoieli asupra rezultatelor studiului, fiind posibil ca declanșarea bolii să fi fost declanșată de către consumul de cannabis, la persoane la care ar fi apărut oricum la un moment dat.
În mod suplimentar, un studiu realizat în 2007 pe pacienți schizofrenici, a arătat o coreație între consumul de cannabis de către aceștia, și îmbunătățirea funcției cognitive.
O serie de studii realizate în 2008 asupra unor utilizatori cronici de marijuana (atenție, fumători, consumatori a cel puțin 5 țigări, ”joint-uri”, zilnic!), au determinat existența unor anomalii cardiace și cerebrale, diferențe în în mărimea hipocampusului și amigdalei (formațiunea cerebrală). S-a sugerat că aceste efecte ar putea fi inversate după o abstinență îndelungată.
Un studiu realizat în Noua Zeelandă, pe circa 1000 de persoane, a descoperit că utilizarea cannabis-ului înaintea vârstei de 18 ani, într-o perioadă în care creierul suferă transformări majore, conduce în medie la o scădere de 8 puncte a coeficientului de inteligență, IQ. Acest efect nu a fost inversat pe deplin după încetarea utilizării cannabis-ului. Alte studii au ajuns la concluzia că începerea utilizării cannabis-ului la vârste mai înaintate este mai sigură.
Metabolismul și detecția în fluidele corporale
THC-ul este metabolizat în 11-OH-THC, metabolit care este și el psihoactiv, și este metabolizat în continuare în 11-nor-9carboxi-THC (THC-COOH). S-au identificat mai mult de 100 de astfel de metaboliți, atât în oameni cât și în animale, dar metaboliții precizați mai sus sunt predominanți. Metabolismul are loc în special în ficat, fiind realizat de către enzimele CCYP2C9, CYP2C19, și CYP3A4, ale citocromului P450. Mai mult de 55% din THC este excretat pe cale fecală, și circa 20% pe cale urinară. Principalii metaboliți care apar în urină sunt esterii acidului glucuronic și THC-COOH, precum și THC-COOH liber. 11-OH-THC a fost detectat în special la eliminarea pe cale fecală.
Toți metaboliții pot fi detectați și cuantificați ca și concentrație în sânge, urină, păr, fluidele orale sau transpirație, prin tehnici specifice de investigație ale medicinei legale.