„Știința” sau mai bine zis „neștiința” modernă ne-a obișnuit cu modul limitat de a privi fenomenele fizice ca fiind tratabile separat (paradigma reducționistă). Generalizarea acestui mod eronat de a privi lucrurile, are efecte în două direcții:
1. Împiedică oamenii de știință adevărați să descopere adevăruri mai profunde despre lumea din jurul lor
2. Ajută excrocii sau neaveniții să păcălească pe cei care nu au o formație științifică riguroasă
În această situație se află și nesfârșita discuție despre „supremația” ionilor sau a nanoparticulelor de argint. Ea totuși a fost tranșată de mult timp, însă tot așa cum în plin secol XXI există grupuri de oameni care mai cred pe baza unor pseudo-dovezi că pământul este plat (da, ați citit bine!), tot așa se petrece și cu așa-numitul argint ionic (care pentru a păcăli oamenii mai este numit suplimentar și coloidal), deși cele două nu au mare lucru în comun.
Pentru început. să observăm că nu există ion de argint mai „magic” decât alt ion de argint. Combinația între ionul de argint (numit și cation) și ionul corespondent (numit și anion), modulează într-o anumită măsură proprietățile compusului de argint.
Nu a existat și nu va exista vreodată un așa-numit ion liber de argint, cu excepția unor stări speciale ale materiei (plasma).
Așadar, ce este un ion? Un ion este o parte dintr-un compus chimic, care este format din doi sau mai multți atomi a două sau mai multe elemente. O poză pentru simplificare:
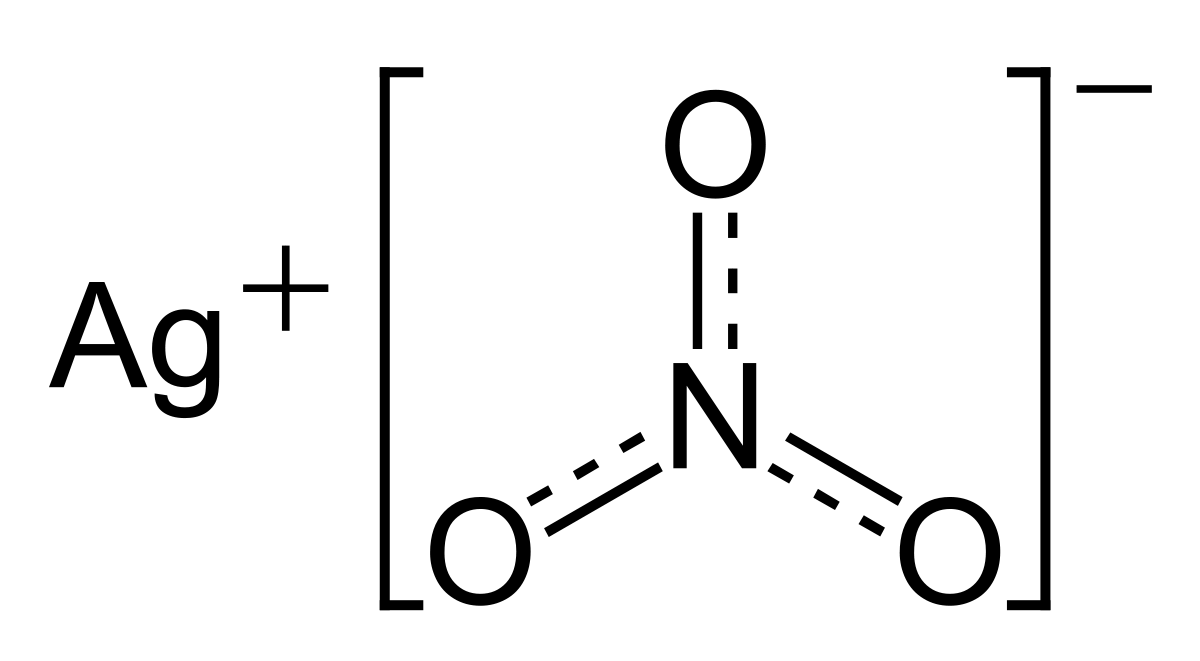
Observăm în figura din stânga faptul că o substanță ionică (în cazul de față nitratul de argint) este compusă dintr-un ion de argint, și un ion complex, numit nitrat.
Pentru a vă ajuta imaginația, să arătăm și o schiță aproximativă, numită „model cu bile”, în dreapta: 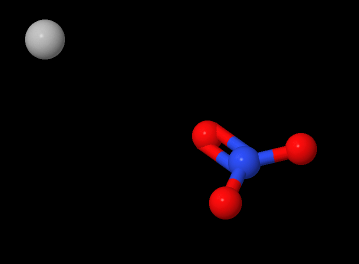
Legătura ionică dintre argint (bila albă) și ionul nitrat, nu este figurată, ceea ce arată faptul că ionul respectiv poate disocia în anumite condiții.
O structură asemănătoare are și hidratul de argint, care în realitate este un oxid de argint hidratat. Oxidul de argint, în apă, are o culoare brună, și nu poate depăși concentrația de 25ppm (la temperatura camerei), dar în anumite condiții, el este puternic hidratat (uzual într-o soluție ceva mai bazică), manifestând un aspect incolor, și putând fi solubilizat pănă la concentrații mai ridicate: 78ppm de exemplu, mai în glumă mai în serios. Un mediu ușor bazic la producere, de obicei asigurat de către un hidroxid, cum ar fi hidroxidul de sodiu sau de potasiu, poate ajuta producerea acestui compus „magic”, numit uneori hidrat de argint, alteori argint ionic (dar nu așa, ionic pur și simplu, ci un fel de „ionic magic”, dacă ne permiteți o glumă).
El este însă, dincolo de „magia” lui, un compus ionic de argint, ca și orice alt compus ionic.
O fotografie în stânga:
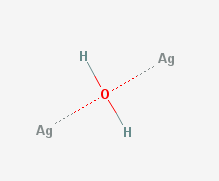
Așadar, doi ioni de argint se vor alătura unei molecule de apă, formând un așa-numit complex argint-apă, și conținând ioni „liberi” de argint. El poate fi privit oarecum ca un hidroxid de argint, care nu poate exista decât în soluție.
Atenție! Această imagine ne prezintă doar un model. Persoanele cu o pregatire și curiozitate adecvată, pot descărca sau vizualiza un articol extensiv despre hidrații ionilor metalici, AICI.
Nu vom insista în această direcție. Există o multitudine de astfel de compuși ionici de argint, nitrați, citrați, oxizi, cloruri, etc.
Pentru articolul de astăzi, clorura de argint este compusul ionic cel mai important. De ce?
Pentru că oricare dintre acești compuși ionici de argint, odată ajunși în stomac, se transformă în clorură de argint. Instantaneu. Fără drept de apel, oricât de „magic” ar fi compusul de argint.
Clorura de argint este un compus de argint oarecum special. Este poate unul dintre cei mai stabili compuși de argint (se descompune termic la temperaturi de peste 2000 grade C (aproape toți ceilalți compuși de argint se descompun mult mai ușor), dar totuși poate fi transformată (prin descompunere) în argint, atunci când este expusă la radiații ultraviolete sau în anumite medii chimice sau biologice.
Așadar, în corp, cu ionul de argint, după ce s-a transformat în clorură, nu mai faci mare lucru, fiind extrem de insolubil, ca și sulfura de argint. Desigur, asta nu îl face lipsit de utilitate, la urma urmei are efect antibacterian. Vrem să spunem că el va rămâne clorură de argint. Adică tot argint ionic, mai în glumă mai în serios.
Hai să vedem două filmulețe care arată aceasta. Mai întâi o ilustrare a reacției ionilor de argint cu clorurile:
Acest experiment îl puteși reproduce oricând și dumneavoastră. Este bine să știți că, de fapt, la fel se petrece și cu nanoparticulele foarte mici de argint, de 0,5nm să zicem. Așadar chiar și anumite sortimente de argint coloidal (nu ionic), vor manifesta un comportament oarecum similar, însă mult mai lent și, cel mai adesea, vor avea la final o altă nuanță, nu albicioasă, ci uneori gălbuie, roșiatică, roz, etc. Vom publica un film comparativ, într-un alt articol.
O animație a fenomenului, mai jos:
Puteți vedea cum ionii de argint, gri, se combină cu cei de clor, verzi, iar apoi moleculele de clorură de argint parcă ” se caută” unele pe altele, pentru a forma flocoane de clorură de argint, cristale de fapt, dar în anumite lichide, precum apa, ele apar ca un precipitat.
Rețineți că. indiferent de ce ați putea crede, acesta este fenomenul care se petrece în stomac, sau în sânge, cu „magicii” ioni de argint.
Desigur, traseul lor nu este încheiat, dar este bine de punctat separat această parte a traseului. De ce?
Pentru că, începănd din acest moment, ei nu mai sunt ce au fost. Cu alte cuvinte, oricât de extraordinare le-ar fi eventual proprietățile într-o eprubetă, în corp ionii de argint au cu totul alte proprietăți, și anume ale clorurii de argint, sau a altor compuși (precum cei formați cu cisteina, etc).
Cu toate acestea, după ce trece de stomac, chiar şi clorura de argint este transformată în nanoparticule complexe, conţinând sulf, clor, argint, conform unui studiu a cărui rezumat îl prezentăm mai departe:
Comportamentul ionilor şi nanoparticulelor de argint, într-un model gastric uman
Agata P. Walczak, Remco Fokkink, Ruud Peters, Hans Bouwmeester
Sumar: Ingestia orală este una dintre căile principale de expunere la nanoparticulele de argint., însă soarta lor după ingestie nu este bine cunoscută. Aceasta a fost studiată utilizând un model digestive uman in vitro. […] Pentru comparaţie s-au utilizat nanoparticule de argint cu diametrul de 60nm, şi azotat de argint (AgNO3). În prenţa proteinelor, după digestia gastrică, numărul nanoparticulelor au scăzut dramatic, însă a revenit la valorile iniţiale după digestia intestinală. Studierea SEM-EDX a arătat că scăderea numărului de particule s-a datorat aglomerării în stomac, aglomerările conţinând clor şi nanoparticule de argint. După digestia intestinală, aglomerările s-au dezintegrat la loc în nanoparticule cu dimensiunea de 60nm (dimensiunea originala, n.n). […] În mod interesant, azotatul de argint, în prezenţa proteinelor, după digestia gastrică, a fost transformat în nanoparticule cu dimensiunea de 20-30nm, compuse din argint, clor şi sulf.
După cum se poate observa, fie că veţi ingera o formă ionică de argint, sau un argint coloidal, după digestia gastrică şi intestinală, rezultatul este acelaşi: nanoparticule. Mai mult, oricât ar fi de mică aşa-zisa dimensiune a ionilor de argint, aceştia se transformă în nanoparticul chiar mărişoare, compuse din clorură de argint.





