Ian F. Pryme1 Truls M. Dale2, Pontus Tilrem2
1Department of Biomedicine, University of Bergen, Jonas Liesvei 91, N-5009 Bergen, Norway
2Palm Research, Lungegaardsbakken 1, N-5015 Bergen, Norway
Rezumat
Lectinele din vâsc (ML) sunt molecule grele glicozilate și acest fapt este important pentru proprietățile lor biologice, însemnând că ele pot fi administrate oral deoarece sunt rezistente atât față de pH-ul scăzut din stomac, cât și față de enzimele proteolitice din intestin. La nivelul intestinului subțire, aceste lectine se leagă de receptori specifici prin care induc producția de citokine și provoacă o eliberare de endorfine. Efectele imunomodulatoare sunt inițiate după legarea acestor lectine de receptori în plăcile lui Peyer. Acest fapt conduce la o activare și la o creștere a numărului de celule naturale ucigașe (NK). ML exercită la nivelul intestinului subțire un efect mitogenetic prin aceea că stimulează creșterea criptelor și vilozităților intestinale. Pe de altă parte, ML pot exercita un efect citotoxic (RIP) asupra celulelor senzitive (de exemplu, celulele canceroase) care au la suprafață receptori de care se poate lega lanțul B. În momentul internalizării lanțului A și al activării sale, este exercitat un efect RIP care conduce la inducția apoptozei, contribuind la moartea celulară. Printr-un mecanism care nu este încă înțeles, ML administrate oral pot induce un răspuns anti-agiogenic la nivelul tumorilor, limitând drastic creșterea acestora. O altă proprietate interesantă a ML adăugată dietei este o modulare a caracteristicilor tumorii, observându-se un nivel crescut de diferențiere. Până acum, preparatele din vâsc au fost administrate prin injecții subcutanate. Totuși, această modalitate de aplicare are în mod clar anumite limitări. Sunt deja adunate dovezi care demonstrează că un preparat care conține lectine din vâsc poate fi administrat pe cale orală și să fie obținute aceleași rezultate ca în cazul administrării subcutanate. Un avantaj clar al administrării pe cale orală este că lectinele din vâsc pot, de exemplu, să intre în contact direct cu tumorile care sunt localizate la nivelul cavității bucale, la nivelul esofagului sau al tractului gastro-intestinal și, astfel, pot exercita un efect citotoxic direct asupra celulelor tumorale. Un alt avantaj al administrării orale este că se evită implicarea personalului medical. Astfel, sugerăm că administrarea pe cale orală a preparatelor de vâsc ce conțin lectine este o alternativă foarte bună pentru formele convenționale de tratament al cancerului.
I. Proprietățile biologice ale lectinelor din vâsc
A. Efectul citotoxic
Folosind metode îmbunătățite pentru separare, Eifler și colegii au fost în stare să izoleze în 1993 trei lectine individuale din vasc, numite lectină I, II și III. Aceste lectine aparțin grupului numit molecule RIP (proteine care inactivează ribozomii) de tipul 2. Aceste molecule constau din două subunități, subunitatea A având proprietatea de inactivare a ribozomilor prin activitatea N-glicozidazei și subunitatea B are o entitate care se poate lega de carbohidrați (recunoaște galactozida). Cele două lanțuri sunt interconetate printr-o punte de suflură (Eschenburg și ceilalți, 1998). Efectul citotoxic, adică RIP, al lectinei are loc ca rezultat al legării specifice a subunității B a lectinei de receptorii potriviți de la suprafața celulei, fapt urmat de internalizarea lanțului A prin endocitoza mediată de receptori. Sandvig și van Deurs au arătat în 1999 că, odată internalizat, lanțul A al unei toxine este transportat în vezicule prin compartimentele endozomale ale celulei și prin aparatul Golgi, fiind probabil transferate în reticulul endoplasmatic.
În timpul transportului prin membrana intracelulară, lanțul A se desfășoară (Agapov și ceilalți, 1999) și, apoi, polipeptida este translocată la nivelul citosolului (Agapov și ceilalți, 1999), domeniul hidrofobic al moleculei fiind expus. În anumite tipuri de celule procesul acesta conduce la activarea unei N-glicozidaze. Enzima activată crestează ARN-ul ribozomal astfel încât ribozomii se destramă efectiv și activitatea de sintetizare a proteinei este oprită. Aceasta conduce la intrarea celulei în procesul de apoptoză. Vervecken și colegii săi au arătat în 2000 că atunci când cele două lanțuri sunt separate, niciunul dintre lanțurile A sau B, de unul singur, nu este în stare să exercite vreo formă de activitate citotoxică. Duong Van Huyen și colegii săi au prezentat în 2006 rezultatele cercetării lor care sugerează că IL-12 joacă un rol important în ceea ce privește proprietățile antitumorale ale lectinelor din vâsc. Recent, Freudlsperger și colegii săi au demonstrat în 2007 că efectele antiproliferative ale ML-1 sunt sporite de inhibitorul proteazomal bortezomib.
B. Activitatea imunomodulatoare
Este bine știut faptul că lectinele din vâsc pot iniția un răspuns imunomodulator (Hajito și ceilalți, 1989). După administrarea lectinelor din vâsc la adulți sănătoși s-a observat o proliferare puternică inițială a celulelor sanguine periferice mononucleare (Stein și ceilalți, 1998). Aceasta a fost însoțită de o creștere a nivelelor sanguine de TNF-alfa și IL-6 și ceva mai puțin a nivelelor de IFN-g și IL-4. Atât Heiny și colegii săi, în 1998, și Baxevanis și colegii săi în 1998 au raportat o creștere a activității celulelor naturale ucigașe (NK) din sângele periferic ca răspuns față de prezența lectinelor. Astfel, au fost observate niveluri plasmatice crescute de b-endorfină (Heiny și ceilalți, 1998), concomitent cu o stimulare a limfocitelor T care prezintă expresia receptorilor CD25/Interleukină-2 și a antigenilor HLA/DR. Un aspect important este că Baxevanis și colegii săi au adus dovezi clare în 1998 că lectinele din vâsc stimulează preferențial și măresc populația celulelor T CD8+. Această populație de celule este cunoscută că mediază un efect citotoxic. În plus, în anul 1997, Schink a raportat că lectinele din vâsc provoacă o creștere atât a numărului, cât și a activității celulelor NK la nivelul sângelui periferic, aceasta într-o manieră dependentă de doză. În studiile lor de imunofenotipare a mostrelor de sânge provenite de la pacienții tratați cu lectine, Gabius și colegii săi au raportat în 1992 un număr crescut de celule NK, activitate crescută a celulelor macrofage peritoneale și, de asemenea, un răspuns al celulelor splenice T față de mitogeni. Astfel, efectele antitumorale ale lectinelor din vâsc au fost atribuite proprietăților lor citotoxice și imunomodulatoare (Hajto și ceilalți, 1990; Burger și ceilalți, 2001).
S-a stabilit acum mai bine de 20 de ani că o creștere masivă atât a numărului tumorilor spontane, cât și a numărului tumorilor experimentale are loc în condițiile unui nivel scăzut al activității celulelor NK (Talmadge și ceilalți, 1980; Gorelik și ceilalți, 1982; Okmura și ceilalți, 1982). Acest fapt a fost în contrast puternic cu animalele care prezentau o activitate crescută a celulelor NK, la care a fost observată o rezistență clară la dezvoltarea metastazelor (Hanna, 1982). Probabil că celulele NK au un rol similar în protejarea împotriva cancerului la om. În cercetarea lor recentă privitoare la stimularea celulelor NK de către agenți folosiți în medicina complementară și alternativă, Takeda și Okumura au sugerat în 2004 că lectinele din plante pot avea un rol important în activarea celulelor NK. Vâscul este enumerat printre alte plante care reprezintă o sursă de componente care sporesc atât numărul, cât și activitatea celulelor NK.
C. Inducția apoptozei
În studiile asupra pro-monocitelor U-937, Wenzel-Seifert și ceilalți (1997) au demonstrat că ML-1 a indus apoptoza printr-un mecanism de semnalizare care implică ionii de Ca2+ intracelular. Studiile lor indică faptul că în reglementarea procesului apoptotic receptorii H-1 și C5a joacă un rol important. O analiză a alterărilor mitocondriale în cazul limfocitelor de la om incubate cu ML-1 a evidențiat generarea de specii de oxigen reactiv și inducția expresiei proteinelor specifice ale membranei mitocondriale (Büssing et al, 1999). Folosind linia de celule T de leucemie la om, MOLT-4, linia de monocite THP-1 și celulele sanguine mononucleare periferice (PBMC), Mockel și colegii săi au studiat în 1997 efectele ML-1, acordând o atenție specială viabilității celulare și asupra declanșării apoptozei. Folosind un test de citotoxicitate, a fost determinată toxicitatea directă a lectinei asupra celulelor MOLT-4, dependența de timp și de concentrație, și valorile IC50 au fost de 20-40pg/ml. După tratamentul timp de 24 de ore cu ML-1, a fost calculat raportul dintre celulele viabile și celulele MOLT-4. Apoptoza și citotoxicitatea au fost corelate la concentrații scăzute și medii. S-a arătat cu această ocazie că în domeniul de concentrații care prezintă o toxicitate scăzută, moartea celulară indusa de ML-1 se datorează cantitativ proceselor asociate cu apoptoza. Datele sugerează că atât apoptoza, cât și semnalizarea celulară sunt induse de concentrații de ML-1 din același domeniu de concentrații. În 1998, folosind o abordare in vitro, Köteles și colegii au remarcat că incubația cu ML-1 a celulelor de carcinom pulmonar la om, iradiate slab cu raze X a declanșat un proces apoptotic la nivelul celulelor deteriorate, dar nu și la nivelul celulelor normale. Un studiu in vivo asupra iepurilor iradiați cu raze X (1 Gy) a condus la același efect asupra celulelor deteriorate. Astfel, autorii au fost în stare să conchidă că efectele dozelor relativ mici de radiație ionizantă, combinate cu administrarea lectinei din vâsc, au fost favorabile vindecării, datorită acțiunii selective asupra celulelor somatice deteriorate.
În 1999, Yoon și colegii au comparat lectinele citotoxice dintr-un extract din vâsc korean [viscum album C. (coloratum): KML-C] cu o lectină extrasă din vâscul european [Viscum album L. (loranthaceae): EML-I]. Ambele lectine au prezentat citotoxicitate puternică față de variate celule tumorale umane și murine, activitatea citotoxică a KML-C fiind cumva mai ridicată decât aceea a EML-I. Atunci când au fost tratate cu KML-C, celulele tumorale au prezentat modele de moarte celulară prin apoptoză, cum ar fi schimbări morfologice tipice și fragmentarea ADN-ului. Activitatea de inducere a apoptozei a fost blocată prin adăugarea de Zn2+, un inhibitor al endonucleazelor dependente de balanța Ca2+/Mg2+, în funcție de doză. În studiile lor asupra celulelor de leucemie la om, HL-60, Pae și colegii săi au arătat în 2000 că incubația cu variate doze de lectină din vâsc korean (ML II) a provocat apoptoză. A fost evident atunci că activarea PKA sau PKC ar putea oferi protecție împotriva apoptozei indusă de către lectină. Acești autori au emis ipoteza că eficiența factorului de necroză tumorală (TNF alfa) împotriva cancerului poate fi crescută de către lectinele izolate fie din vâscul european, fie din vâscul korean (Pae și ceilalți, 2000). Acești cercetători au demonstrat că tratamentul simultan cu lectine al celulelor HeLa de carcinom cervical la om sau al celulelor MCF-7 de carcinom la sân a făcut aceste celule mult mai sensibile la inducția apoptozei de către TNF-alfa. În studiile lor din 2001 asupra celulelor cultivate de hepatocarcinom SK-Hep1, Pae și colegii au folosit testul cu tetrazolium în microcultură și au arătat un efect sinergic al ML-I asupra citotoxicității in vitro a unui medicament anticanceros important, paclitaxel. Pae și colegii au arătat în 2001 că tratamentul celulelor U937 (o linie de celule monoblaste de leucemie) cu ML-II korean a provocat fragmentarea apoptotică a ADN-ului, aceasta fiind precedată de activarea ERK1/2, p38 MAPK și SAPK/JNK. Stein și colegii au stabilit în 2000 că expresia intracelulară a IL-4 și inhibarea producției de IFN-g sunt procese care sunt implicate în inducția apoptozei în cazul celulelor U-266 de plasmocitom și al celulelor T de leucemie.
Folosind celule HL-60, Lyu și colegii au arătat în 2001 că adăugarea de aglutinină din Viscum album L. coloratum (VCA) a condus la o suprimare a creșterii celulelor, dependență de doză și de timpul de expunere, precum și la schimbări morfologice ale nucleului celular și la fragmentarea ADN-ului, caracteristică apoptozei. Pentru a investiga cum a fost posibil ca activarea caspazei-3 în timpul apoptozei induse de VCA a indus clivajul PARP, au fost studiate exresia lui PARP și modelul activării caspazei-3 în cazul celulelor HL-60. Astfel, au fost observate atât formele native, cât și cele procesate de PARP, precum și o scădere a expresiei formei 32-kDa a caspazei-3 într-o manieră dependentă de doză. Apoptoza indusă prin VCA a fost afectată în mod semnificativ de către un inhibitor specific al caspazei-3, z-DEVD-FMK, și atât procesarea PARP, cât și activarea caspazei-3 au fost inhibate, de asemenea, de către respectivul agent inhibitor. Folosind lectină-II din vâsc korean, Kim și colegii au arătat în 2000 inducția specifică a mortii celulare prin apoptoză în cazul celulelor canceroase, deși acest fapt nu a fost observat atunci când au fost testate limfocitele normale. Atunci când celulele U937 au fost incubate cu ML-II, a fost indusă fragmentarea modelului de scară al ADN-ului și, mai mult, a fost observată activarea caspazei 3, 8 și 9 într-o manieră dependentă de timp și de doză, dar nu și a proteazei caspază-1. Rezultate similare au fost obținute de Park și colegii săi în 2000, când celulele U937 au fost incubate lectina II din vâsc, ce are în mod specific beta-galactozidă și N-acetil-d-galactozamină. Inducția morții celulare prin apoptoză a fost evidentă la 12 ore după tratament și a fost caracterizată de fragmentarea modelului de scară a ADN-ului și, de asemenea, a fost observată o creștere marcată în activitatea fosfotransferazei în cazul unor kinaze (SAPK) corelate cu apoptoza. Activarea catalitică a JNK1 de către lectină a fost inhibată de adăugarea peptidei aC-DEVD-CHO, dar nu și a peptidei aCYVAD-CHO. Acești cercetători au stabilit, de asemenea, că incubația cu ML-II a condus la apoptoză în cazul mai multor tipuri de celule, incluzând celulele T Jurkat, celulele RAW 264,7, celulele HL-60, celulele DLD-1 și celulele leucemiei acute mielocitare. Lyu și colegii au observat în 2002 că lectina din vâsc korean (aglutinina din Viscum album L. coloratum, VCA) a indus apoptoza atât în cazul celulelor SK-Hep-1 (p53-pozitiv), cât și în cazul celulelor Hep 3B (p53-negativ), unde au fost implicate căile independente p53- și p21. În cazul ambelor linii de celule a fost raportată scăderea Bcl-2 și creșterea Bax. În plus, a fost observată scăderea activității telomerazei în ambele linii de celule de hepatom tratate cu VCA. Astfel, aceste rezultate au oferit în mod clar dovezi directe pentru potențialul antitumoral al acestui răspuns biologic provocat de inhibarea telomerazei și de inducția apoptozei. Aceste observații sunt importante cu privire la terapiile care folosesc lectinele din vâsc deoarece ele demonstrează că un mecanism dependent de telomerază poate fi influențat de VCA în cazul celulelor de hepatocarcinom la om. În plus, aceste rezultate sugerează că VCA, funcționând ca un inhibitor al telomerazei, poate fi considerat un candidat important pentru creșterea sensibilității la medicamentele anticancer convenționale. Choi și colegii au observat în 2004 că VCA a fost în stare să inducă moartea celulară prin apoptoză în cazul celulelor A253 tratate cu VCA, prin activarea caspazei-3 și inhibarea activității telomerazei, ce are loc prin inhibarea transcripției hTERT.
D. Efectele anti-angiogenice ale lectinelor din vâsc
Angiogeneza descrie procesele prin care capilare sanguine noi se dezvoltă și cresc pe baza unui pat capilar existent. Acest proces are o funcție foarte importantă în timpul dezvoltării progresive a unei tumori și a metastazării sale (Folkman, 1995). Angiogeneza tumorală include un număr de evenimente cum ar fi producția și eliberarea factorilor angiogenici, creșterea numărului moleculelor implicate în adeziunea celulară și creșterea proliferării celulelor endoteliale de la nivelul țesutului tumoral (Carmeliet, 2000; Keshet și Ben-Sasson, 1999). Duong Van Huyen și colegii au concluzionat în 2001 că un extract îmbogățit cu lectine din vâsc a fost capabil să susțină intrarea celulelor endoteliale în apoptoză, afectând astfel procesul angiogenic în cazul unei tumori. Acești autori sugerează că efectul anti-angiogenic observat poate juca un rol important în proprietățile antitumorale ale lectinelor din vâsc. Studii clinice în fazele I-III sunt în curs de desfășurare pentru a testa potențialul diferitelor abordări antiangiogenice ca forme noi ale tratamentului în cazul pacienților bolnavi de cancer (Folkman și ceilalți, 2001).
Yoon și colegii săi au studiat în 1995 efectul inhibitor al unui extract apos (KM-110) preparat din Viscum album coloratum (o specie de vâsc korean) asupra metastazelor produse de o serie de celule tumorale murine cu potențial metastatic ridicat: melanom B16-BL6, carcinom la colon 26-M3.1 și celule de limfom L5178Y-ML25. Atunci când a fost administrat pe cale intravenoasă KM-110 (100 micrograme/cobai) la o zi după inocularea tumorii, a fost observată o inhibare semnificativă a metastazelor la plămâni, atât în cazul celulelor B16-BL6, cât și în cazul celulelor 26-M3.1. În cazul celulelor de limfom L5178Y-ML25 a fost observat, de asemenea, un efect terapeutic în ceea ce privește metastazele la ficat și splină. O observație interesantă este că în cazul metastazelor spontane ale celulelor de melanom B16-BL6, administrarea multiplă a KM-110 în cazul cobaiului cu tumoră a provocat o inhibare semnificativă a metastazelor la plămâni în plus față de suprimarea creșterii tumorii primare. Studiile in vivo asupra angiogenezei induse de tumoră au demonstrat că administrarea intravenoasă a KM-110 a inhibat numărul de vase sanguine care erau orientate către masa tumorală. Rezultatele studiilor au sugerat că efectul antimetastatic al unui extract de vâsc korean asupra unor serii de linii de celule tumorale la cobai s-a datorat în parte datorită unei inhibări a angiogenezei induse de tumoră. Această inhibare a angiogenezei susținută de tumoră a fost atribuită declanșării producției de TNF-alfa.
În 2001, Park și colegii săi au inoculat cobai C57BL6 cu celule de melanom B16-BL6 și au realizat studii pentru a examina mecanismul activității anti-cancer și antimetastatice după administrarea lectinei purificate din vâsc korean (aglutinina din Viscum album L. coloratum, VCA). Pentru a măsura activitatea anti-angiogenică a VCA testul membranei corio-alantoice a fost folosit. Rezultatele studiului au indicat că VCA a redus creșterea tumorii și proliferarea metastatică prin două mecanisme: 1) un efect anti-angiogenic și 2) prin stimularea apoptozei.
Într-un studiu recent, Pryme și colegii săi au observat în 2006 că o tumoare de limfom non-Hodgkin (NHL) crescută subcutanat la cobai avea un sistem capilar foarte bine dezvoltat. La disecție tumorile erau extrem de pline de sânge și microscopia a evidențiat o retea de capilare bine dezvoltate. Totuși, în cazul animalelor hrănite cu o dietă conținând ML-I purificată (Eifler și ceilalți, 1993), tumorile NHL au fost de culoare albă și au fost considerate a avea o vascularizație slab dezvoltată. Acest fapt a fost confirmat de către examinarea morfologică a secțiunilor tumorale provenite din tumorile NHL care s-au dezvoltat la cobai hrăniți cu ML-I. Rezultatele au evidențiat o incidență redusă semnificativ a vascularizației tumorale la cobaii cărora li s-a administrat lectină (Pryme și ceilalti, 2006). Astfel, aceste observații indică că unul dintre răspunsurile la administrarea orală de ML-I este inducția producerii factorului anti-angiogenic. Un fapt interesant este că folosirea dietelor îmbogățite cu ML-I a condus la ablația completă a tumorii NHL la 6 din 25 de cobai, judecând după criteriile histologice (Pryme și ceilalți, 2004). Astfel, este evident că administrarea lectinelor provenite din vâsc european sau korean, fie pe cale orală, fie pe cale intravenoasă, este capabilă să declanșeze un răspuns antiangiogenic în animalul gazdă. Aceste observații sunt importante în ceea ce privește administrarea lectinelor din vâsc în tratamentul cancerului.
E. Legarea lectinei din vâsc de receptorii de la suprafața celulelor din intestinul subțire
Mai bine de 80% dintre țesuturile asociate cu sistemul imunitar al corpului sunt strâns asociate cu tractul gastrointestinal. Acest țesut este cunoscut ca țesutul limfoid asociat intestinului subțire (GALT) și o componentă importantă a acestui țesut este constituită de celulele limfoide ale plăcilor lui Peyer. Foliculii limfoizi subepiteliali oferă cel mai important loc pentru prelevarea de mostre de antigen din intestinul subțire și constituie un mecanism efector pentru răspunsurile imunitare secretorii ale GALT (Roy și ceilalți, 1987). Importanța acestui mecanism este dublă. Mai întâi, un răspuns imunitar este vital, astfel încât să poată opera protecția țesuturilor gazdă împotriva microorganismelor care invadează corpul; în al doilea rând, prin acest mecanism, extinderea unei infecții poate fi stopată cât se poate de mult (Kraehenbuhl și Neutra, 1992). Foliculii limfoizi sunt suprapuși cu epiteliul asociat foliculului (FAE) care include un număr de tipuri de celule , cum ar fi limfocite, enterocite, celule caliciforme, celule membranoase (M) și celule pre-M (Gebert si Hach, 1993).
În studiile făcute pe specimenele de intestin subțire uman conținând plăcile lui Peyer, Sharma și colegii săi au arătat în 1996 cu ajutorul histochimiei că lectina din vâsc s-a legat atât de enterocite, cât și de celulele M ale FAE. Așadar, este evident că suprafața intestinului subțire la om conține receptori care leagă lectinele din vâsc.
Pusztai și colegii săi, folosind imunohistochimia, au arătat în 1998 că ML-I s-a legat masiv de membranele celulelor villus și de celulele epiteliale din criptele intestinului subțire la șobolan. Folosind cobai, Lavelle și colegii (Lavelle și ceilalți, 2000, 2001, 2002) au demonstrat clar că atunci când este administrat pe cale orală ML-I a condus la producerea unui ser specific cu anticorpi IgG și IgA. Aceste rezultate sunt compatibile cu inducția selectivă a răspunsurilor imunitare de tip Th2. Winge și ceilalți au arătat că atunci când adulții au băut ceai de vâsc îmbogățit cu lectine timp de trei luni, anticorpii ML au putut fi identificați la nivelul serului. Anticorpii specifici administrării vâscului nu au fost detectați la nivelul serului provenit de la indivizii care nu au ingerat ceaiul de vâsc.
F. Inducția hiperplaziei la nivelul intestinului subțire
Lectinele din vâsc pot exercita simultan atât un efect de susținere a creșterii (hiperplazia intestinului subțire), cât și un efect de prevenire a creșterii (scăderea masei tumorale) la animalele folosite pentru experiment. În experimentele cu ML-III s-a observat că, deși creșterea tumorală a NHL a fost redusă la cobai, totuși nu s-a sesizat niciun efect asupra greutății organelor importante, precum rinichii, ficatul și mușchiul gastrocnemian. Este interesant de notat că în aceste experimente și în studiile similare (Pryme și ceilalți, 2004, 2006), unde a fost adăugată în dieta ML-I, reducerea creșterii tumorale nu se datorează unui efect citotoxic direct al lectinei asupra celulelor tumorale, ci, mai degrabă, se datorează stimulării unui răspuns antitumoral dat de animalul gazdă.
II. Administrarea orală a lectinelor din vâsc
A. Lectina din vâsc administrată în dieta și creșterea tumorilor
Deoarece ingestia vâscului de către om poate conduce la apariția unor stări de greață, în cadrul anumitor grupări, extractele de vâsc au fost considerate toxice. Totuși, două rapoarte au examinat efectele rezultate în urma ingerării accidentale de vâsc în mai bine de 2000 de cazuri. Rezultatele lui Hall în 1986 și Krenzelok în 1997 au arătat destul de convingător că nu este nicio dovadă medicală care să sugereze toxicitatea vâscului la om. Așadar, nu sunt motive pentru a considera vâscul toxic în urma administrării pe cale orală.
Dacă lectina din vâsc ajunge în sânge ea este foarte rapid inactivată. Frantz și colegii au stabilit în 2000 că glicoproteinele serice, în special haptoglobina, dar, de asemenea, și alfa1-glicoproteina acidă și transferina sunt capabile să inhibe proprietățile lectinelor din vâsc, ML, de a induce apoptoza. În plus, Stein și colegii au descoperit în 1997 că anticorpii anti-vâsc au fost capabili să neutralizeze efectul citotoxic al lectinei din vâsc asupra celulelor sanguine mononucleare periferice. În plus, s-a arătat că anticorpii împotriva lectinelor din vâsc, produși în pacienți în timpul terapiei cu un extract apos din vâsc, au neutralizat citotoxicitatea indusă de lectină in vitro (Stein și ceilalți, 1990).
Folosind ML-I purificată, Eifler și colegii, în 1993 și Pusztai și colegii, în 1998, au studiat efectele ML-I administrată pe cale orală la șobolani pentru a stabili dacă lectina produce vreun efect secundar. Șobolanii au fost hrăniți cu diete semisintetice, conținând 67 până la 200 mg ML-I/kcorp, timp de 10 zile și au fost examinați o serie de parametri de creștere. În ciuda faptului că dozele mari de ML-I au provocat o reducere a hranei ingerate voluntar și au condus, astfel, la o rată redusă de creștere, totuși, nu s-a observat nicio pierdere a greutății. Nu s-au remarcat efecte negative în ceea ce privește digestibilitatea proteinelor sau a altor compuși digestivi. S-a observat o pierdere crescută de azot prin urină, atunci când a fost testat nivelul cel mai ridicat de ML-I, acest fapt conducând la reducerea balanței globale de azot și a conținutului total de azot din corp. Oricum, nu a fost afectată nici greutatea fecală, nici conținutul de azot al acesteia. Atunci când a fost administrată șobolanilor lectina fitohemaglutinina (PHA) extrasă din fasole, s-au observat nivele reduse de insulină serică (Pusztai 1991; Bardocz și ceilalți, 1996). Același fenomen s-a observat atunci când s-a administrat șobolanilor ML-I. La 30 de ore după administrarea ML-I, s-a remarcat o creștere semnificativă a TNF-alfa la nivelul plasmei. De asemenea, s-au remarcat nivele plasmatice ridicate de interleukină-1b. Acest fapt indică că producția și eliberarea citokinelor, procese care sunt considerate a fi un pas important ce conduce la imunomodulație, culminând cu încetinirea și oprirea creșterii tumorii (Mannel și ceilalți, 1991), au fost stimulate după administrarea ML-I șobolanilor.
Examinarea histologică a tumorilor NHL obținute în cazul cobailor hrăniti cu diete de control a evidențiat prezența unui tip de celule blastice destul de mari, care conțineau un număr mare de figuri mitotice. Pe de altă parte, tumorile care s-au dezvoltat în cazul cobailor hrăniți cu diete suplimentate cu ML-I au evidențiat prezența unor celule care erau mai mici și erau aranjate într-o manieră care sugera un nivel ridicat de diferențiere (Pryme și ceilalți, 2002). Astfel, a fost evident că administrarea pe cale orală a ML-I a fost capabilă să moduleze aparența morfologică a unei tumori murine NHL.
S-a remarcat că caracteristicile tumorilor NHL la cobaii hrăniți cu diete conținând ML-I (până la 10 mg de lectină pe zi) au fost diferite de cele ale cobailor hrăniți cu diete de control (Pryme și ceilalți, 2004). În cazul administrării celei mai crescute cantități de lectină (10 mg), activitatea mitotică la nivelul tumorilor și zona nucleară în celulele tumorale s-au redus, respectiv, cu 75% și 21%. Numărul mitozelor din celulele tumorale s-a redus de la 7,4 (control) la 1,7 în cazul tumorilor la cobaii hrăniti cu cea mai mare cantitate de lectină ML-I.
În figura 1 sunt prezentate datele care arată schimbări la nivelul masei tumorale 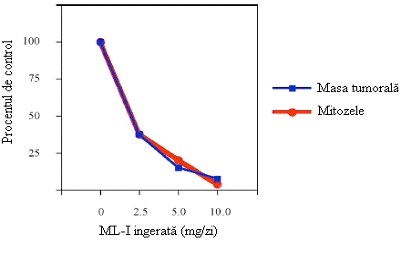 și al numărului de mitoze din celulele tumorale în raport cu administrarea orală de ML-I pe calea dietei. Rezultatele demonstrează clar că scăderea masei tumorale este însoțită de o scădere simultană a activității mitotice la nivelul tumorii. Un fapt interesant este că în 4 din 15 cobai hrăniți cu o dietă conținând ML-I timp de 11 zile nu s-a mai găsit nicio tumoare viabilă. Aceste rezultate arată că ML-I exercită efecte antitumorale puternice atunci când este inclusă în dietă.
și al numărului de mitoze din celulele tumorale în raport cu administrarea orală de ML-I pe calea dietei. Rezultatele demonstrează clar că scăderea masei tumorale este însoțită de o scădere simultană a activității mitotice la nivelul tumorii. Un fapt interesant este că în 4 din 15 cobai hrăniți cu o dietă conținând ML-I timp de 11 zile nu s-a mai găsit nicio tumoare viabilă. Aceste rezultate arată că ML-I exercită efecte antitumorale puternice atunci când este inclusă în dietă.
Pryme și colegii au studiat în 2006 efectul hrănirii cobailor cu dieta de control LA, sau cu o dieta conținând trei concentrații diferite de lectină ML-I (0,42, 0,83 și 1,67 mg/g dietă), asupra creșterii unui limfom non-Hodgkin pe o perioadă de 10 zile. Concentrația cea mai scazută de lectină testată a avut un efect apreciabil asupra creșterii tumorii, de vreme ce masa tumorală a fost redusă cu aproximativ 25%, în vreme ce concentrația cea mai mare de ML-I a provocat o scădere a masei tumorale de aproximativ 40%. Examinarea morfologică a tumorilor NHL a evidențiat (i) o intensă infiltrație a celulelor T, (ii) un număr crescut de celule apoptotice și (iii) o incidență redusă drastic a vascularizării tumorale, fapt care indică debutul unui răspuns antiangiogenic. Deoarece este foarte improbabil ca lectina să fie responsabilă direct pentru efectul observat, atunci cei implicați sunt factorii din sânge. În experimentele cu cobai injectați intramuscular cu 5×105 celule tumorale Lewis de la nivelul plămânului, Kubasova și ceilalți (1998) au arătat că administrarea de ML-I (pe cale orală sau pe cale subcutanată) a redus ocurența metastazelor la plămâni. Atunci când s-a administrat timp de 19 zile o dietă conținând ML-I, numărul total de metastaze pe suprafața plămânului a fost redus cu 75%.
Într-o serie de studii în care PHA a fost adăugată în dietă, administrarea lectinei a condus la nivele scăzute de creștere a tumorii NHL la cobai (Pryme și ceilalți, 1994, 1995, 1996, 1998, 1999). Totuși, spre deosebire de observațiile făcute asupra ML-I, nu a avut loc nicio ablație completă a tumorii atunci când a fost folosit PHA. În plus, folosirea PHA nu a condus la vreun răspuns antiangiogenic, cum s-a observat la folosirea ML-I. Astfel, este evident că, deși PHA și ML-I se leagă de receptorii mucoasei intestinale, este evident că ele declanșează răspunsuri fiziologice diferite. Așadar, răspunsul biologic actual al lectinelor individuale poate depinde de natura specifică a componentei de zahăr implicată în recunoașterea receptorilor.
În plus față de ML-I, experimente cu ML-III purificată au dat rezultate similare în sensul că administrarea lectinei la cobai a fost eficientă în reducerea dezvoltării ulterioare a tumorilor NHL (Pryme și ceilalți, 2002). Masa uscată a ficatului, rinichilor și a mușchiului gastrocnemian a rămas neschimbată.
Rezultatele arată clar că, atunci când sunt incluse în dietă, atât ML-I, cât și ML-III sunt capabile să inducă un efect puternic anticancer. Se pare că modul în care lectinele exercită acest efect este rezultatul unei serii de evenimente.
B. Influența unei combinații a administrării în dietă a PHA și a unui nivel scăzut de ML-I asupra dezvoltării tumorii
În prezent, nu sunt disponibile din punct de vedere comercial cantități suficiente de lectină ML-I purificată. Așadar, nu este posibil să se facă experimente frecvente la scară mare pe animale, în care să fie introdusă în dieta acestor animale lectină din vâsc. Într-o încercare de a reduce cantitățile necesare de ML-I, a fost conceput un experiment pentru a studia regimul administrării secvențiale de lectină, în care durata administrării lectinei ML-I a fost redusî la o perioadă limitată de timp și a fost cuprinsă între două perioade de administrare a PHA (PHA, 7 mg/g dietă, timp de 5 zile, ML-I, 1,7 mg/g dietă, timp de 4 zile și apoi din nou PHA timp de 7 zile). Grupul de control a fost hrănit cu o dietă La, fără adiția lectinei. Rezultatele au arătat că în cazul cobailor hrăniți cu o dietă ce conține lectină, masa tumorilor NHL a fost aproximativ 35% din cea observată în cazul grupului de control (Pryme și ceilalți, 2000). Rata mitozelor în cazul tumorilor NHL provenite de la cobaii hrăniți cu o dietă ce conține lectină a fost cuprinsă între 35 și 41 (cu valoare medie de 36,5), în vreme ce valorile corespunzătoare pentru cobaii hrăniți cu La au fost de 79-115 (cu valoarea medie de 94). Astfel, a fost clar că administrarea unei diete ce conține lectină are un impact major asupra activității mitotice de la nivelul celulelor tumorale.
Reducerea dimensiunilor masei tumorale în cazul cobailor cărora li s-a administrat PHA/ML-I, comparativ cu cobaii cărora li s-a administrat hrana La (media 35%), a fost de același ordin de mărime cu aceea observată în cazul scăderii ratei mitotice (media 39%).
Din datele disponibile a fost evident că regimul de hrănire cu o dietă ce conține lectine a avut un impact major asupra creșterii și dezvoltării tumorii murine NHL. Pentru a stabili dacă au fost sau nu semne de citotoxicitate în cazul tumorilor individuale, a fost realizată analiza microscopică a nivelelor de infliltrație a limfocitelor și a gradului de necrozare.
A fost realizată o examinare a nivelelor de inflitrație limfocitară și a gradului de necrozare în cazul tumorilor prelevate de la cobai. S-a observat că existau diferențe majore între parametrii specifici celor două grupuri. Tumorile în cazul cobailor hrăniți cu o dietă ce conținea lectină au fost infiltrate într-o măsură mult mai mare cu limfocite CD3+ decât tumorile corespunzătoare din grupul de control. Nivelul mai ridicat de inflitrație cu limfocite în cazul animalelor din grupul hrănit cu o dietă ce conținea lectine a fost însoțit de un nivel asemănător de înalt al necrozei înregistrate în cazul tumorilor individuale ale cobailor hraniți cu această dietă. Din 16 observații, numai unul dintre cobaii cărora li s-a administrat lectină a ieșit pozitiv, în vreme ce în cazul grupului de control, numărul de cobai pozitivi a fost de 5.
În cazul grupului hrănit cu PHA/ML-I, masa tumorală a variat de la 0,44 g la 0,83 g, dar în ciuda acestor variații nu au fost diferențe în rata mitotică. Aceasta a fost în contrast cu grupul de cobai de control, hrăniți cu La, unde activitatea mitotică a fost extrem de crescută în tumora cu masa cea mai mică (1,33 g). În acest grup rata mitotică a scăzut cu creșterea dimensiunilor tumorii, aproape într-o manieră liniară. Este interesant faptul că masa tumorii celei mai mari (2,22 g) în cazul grupului de control, hrănit cu La, a fost de 5 ori mai mare decât aceea a tumorii celei mai mici din grupul de cobai cărora li s-a administrat lectină (0,44 g), dar a avut o rată mitotică dublă. Acest fapt arată că creșterea tumorilor NHL la cobaii cărora li s-a adăugat lectină în dietă a fost la un nivel extrem de scăzut, comparativ cu cobaii din grupul de control.
Faptul că această administrare secvențială a lectinei în dietă a condus la un răspuns citotoxic la nivelul tumorii este indicat de rata mitotică mult scăzută precum și de către nivelul mai ridicat de infiltrație limfocitară și de gradul mai ridicat de necrozare, valori net diferite față de valorile observate în cazul grupului de control, cu hrană La. În cazul acestui grup, necroza a fost prezentă la un nivel foarte scăzut. Bazându-ne pe rezultatele descrise aici, pare puțin probabil ca administrarea secvențială a dietei conținând lectină declanșează o serie de evenimente în organismul gazdă care culminează cu un răspuns citotoxic la nivelul țesutului tumoral, modulat probabil printr-o eliberare de diferite citokine, prin imunostimulare și prin activarea celulelor naturale ucigașe NK. Totuși, cantitatea redusă de ML-I folosită în combinație cu PHA în aceste experimente nu a fost tot atât de eficientă ca nivelul ridicat de ML-I folosit la sfârșit pentru a îndepărta tumora NHL (Pryme și ceilalți, 2004), deoarece folosind dieta cu PHA/ML-I scăzută nu au existat supraviețuitori.
O observație interesantă a fost făcută într-un experiment paralel, unde a fost administrată doar PHA unui grup de cobai, observându-se un efect vizibil asupra nivelelor proteinei de soc caloric (HSP) 70. Proteinele de soc caloric formează un grup de proteine care se conservă foarte bine (Cooper, 2000) și care sunt renumite pentru funcțiile lor de serviciu la nivelul celulelor. Atunci când o celula este expusă la stimuli stresori, multe dintre proteinele sale pot să fie deteriorate sau denaturate. Atunci, expresia HSP crește dramatic și aceasta asistă la reînfășurarea proteinelor înfășurate incorect și promovează eliminarea proteinelor deteriorate în mod ireversibil. Astfel, nivelurile crescute de HSP protejează celula, în parte datorită suprimării apoptozei (Samali, 1998). Reversul acestui fapt este ca HSP protejează, de asemenea, celulele canceroase să intre în procesul de moarte celulară programată.
Dintre cele cinci grupuri principale de HSP, familia 70kDa este cel mai bine studiată. HSP70 este importantă în cancer deoarece ea suprimă apoptoza prin inhibarea reacției în lanț specifică caspazei (Sreedhar și Csermely, 2004) și, prin urmare, funcționează ca o proteină de supraviețuire. De asemenea, această proteină realizează complexe puternice cu proteina mutantă supresor tumoral p53 (Helmbrecht și ceilalți, 2000; Jolly și ceilalți, 2000) și, în consecință o împiedică pe aceasta din urmă să intre în nucleul celulei pentru a activa transcripția. Dezvoltarea tumorilor maligne poate fi privită ca un proces de selecție, în care celulele care și-au pierdut abilitatea de a muri (adică de a intra în apoptoză) sunt favorizate (Nylandsted și ceilalți, 2004). Supraexprimarea proteinei HSP70 a fost stabilită în cazul tumorilor maligne cu origini variate. Astfel, nivelurile crescute ale acestei proteine sunt asociate cu un prognostic nefast în cancer (Ciocca și ceilalți, 1993; Lin și ceilalți, 1994; Vargas-Roig și ceilalți, 1998). S-a dovedit că dacă HSP70 este eliminată dintr-o celulă, atunci apoptoza este indusă spontan (Rohde și ceilalți, 2005). Așadar, inhibarea sintezei proteinei HSP70 apare a fi o abordare nouă și promițătoare pentru cancerele la om, rezistente la terapiile standard (Nylandsted și ceilalți, 2000).
Nylandsted și colegii au concluzionat în 2004 că transfecția cu antisens adenoviral HSP70 cADN (Ad.ashp70), care conduce la reducerea expresiei proteinei HSP70, sporește moartea celulară in vitro. Totuși, folosirea adenovirusului ca un vector (pentru transferul Ad.ashp70) în tratamentul oamenilor poate fi problematică. Aceasta în primul rând datorită eficienței relativ limitate a infecției, dar, de asemenea, și pentru ca reacția imunitară care are loc poate fi deranjantă pentru pacienții cu cancer ce sunt de obicei imunosupresați.
O nouă abordare folosind lectina se pare că este o modalitate foarte promițătoare prin care nivelele de HSP70 pot fi reduse la nivelul celulelor tumorale (Dale, 2003). S-a demonstrat că lectina din fasole, PHA, atunci când este adăugată în hrana cobailor, conduce la o reducere semnificativă a nivelelor de HSP70 în cazul celulelor NHL ce creșteau intraperitoneal la cobai (fig. 2).
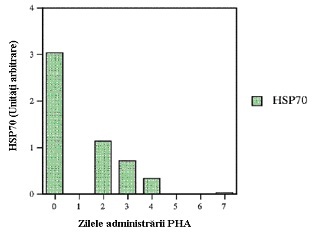
S-a arătat că includerea PHA în hrană provoacă diminuarea creșterii tumorii NHL la cobai (Pryme și ceilalți, 1998). Rezultatele prezentate în fig. 2 arată că, atunci când cobailor injectați cu celule NHL li s-a administrat o dietă conținând PHA, a avut loc o reducere drastică a nivelelor de HSP70 într-o manieră dependentă de timp. După două zile de administrare PHA, nivelul HSP70 s-a redus deja cu 65% și două zile mai tarziu nivelul a ajuns la 10% din cel exprimat în celulele NHL din cobaii care nu au fost hrăniți cu lectină. La șapte zile după injecție, HSP70 era virtual nedetectabil. Ceea ce este uimitor este că efectul este observat după consumul unei hrane cu proteine vegetale normale. Doar o difuzie a PHA din lumenul intestinal în cavitatea intraperitoneală este prea puțin probabilă deoarece PHA este o proteină mare 118kDa (Pusztai și Stewart, 1978). În plus, lectina se leagă avid de epiteliul stomacului, al intestinului subțire și al intestinului gros (Pusztai și ceilalți, 1990; 1995), de unde s-a postulat că un al doilea răspuns evocă o stimulare a transcripției și provoacă o eliberare ulterioară de molecule biologic active din celulele care devin atunci capabile să inducă o formă a răspunsului sistemic (Bardocz și ceilalți, 1995). După intrarea în fluxul sanguin, se pare că un anumit factor trece prin pereții capilari și în fluidul intraperitoneal unde intră în contact cu celulele NHL. După internalizare, transcripția genei HSP70 ar fi afectată, conducând la nivele reduse de proteină HSP70. Aceste rezultate preliminare pot fi de o importanță majoră deoarece este evident că administrarea pe cale alimentară a unei singure lectine este capabilă să inducă un răspuns în corp, care este în detrimentul proliferării celulelor canceroase.
Rezultatele discutate aici sunt în acord cu comentariile făcute în recenzia lui González de Mejía și Prisecaru în 2005, unde este sugerat că lectinele prezente în alimentele obișnuite posedă un potențial ridicat ca agenți anticancerigeni. Totuși, este important să reținem că lectinele trebuie ingerate într-o formă activă. Din acest punct de vedere, amintim faptul că majoritatea metodelor moderne de preparare a hranei conduc la denaturarea unor asemenea molecule valoroase.
C. Un ceai de vâsc îmbogățit cu lectine
Palm Research AS a produs un ceai îmbogățit cu lectine din vâsc, din care au fost îndepărtate moleculele care provoacă greața. Concentratul din ceai este diluat la rece pentru a preveni denaturarea lectinelor. Într-o investigație făcută pentru a evalua dacă prepararea ceaiului ar putea stimula sistemul imunitar, opt oameni sănătoși au băut ceaiul zilnic timp de trei luni (Winge și ceilalți). Au fost recoltate probe de sânge înainte și pe parcursul perioadei de trei luni. Toți cei analizați au dezvoltat anticorpi față de lectine, fapt care a dovedit că în toți acești oameni a fost indus un răspuns imunitar. Examinarea unui imunoprofil a relevat că patru tipuri de celule au evidențiat un răspuns marcant în toate valorile: celulele ajutătoare activate IL-2, celulele de memorie, celulele T activate și celulele naturale ucigașe activate (NK). În general, nivelele celulelor ajutătoare activate IL-2 și ale celulelor de memorie au fost ridicate după o lună, cu o revenire la nivelele normale după trei luni. La începutul investigației s-a observat că patru persoane au avut nivele ale celulelor NK destul de mult sub valorile normale. După trei luni valorile s-au ridicat la valori normale. Rezultatele au arătat că ceaiul îmbogățit cu lectine din vâsc este în stare să activeze sistemul imunitar specific. Astfel, este evident că ceaiul de vâsc prezentat aici este în stare să funcționeze ca un supliment alimentar extrem de eficient pentru imunostimulare. Bazați pe rezultatele pozitive apărute în urma consumării ceaiului îmbogățit cu lectine din vâsc, un număr de pacienți cu cancer terminal au testat preparatul din propria lor inițiativă. Mai jos sunt prezentate rezumatele experiențelor personale a două dintre aceste persoane:
1. Experiența 1
Femeie de 61 de ani, diagnosticată cu cancer la sân. Avea, de asemenea, metastaze la nivelul axilei. Deoarece tumora era mare (7 cm) mai întâi i s-au administrat 5 ședințe de chimioterapie astfel încât să se mai reducă dimensiunile tumorii. Apoi, a fost operatp și după operație i s-au mai administrat 25 de ședințe de iradiere. Aceasta a condus la deteriorarea plămânilor. Atunci, ea a consumat ceai de vâsc timp de 1 an de zile. Ea a raportat că s-a simțit mult mai încrezătoare și că acum avea cancerul „sub control”. Ea a avut un apetit mult mai bun și a fost „mult mai plină de energie”. Nu a avut efecte secundare de la acest ceai și nici nu a raportat vreo reacție alergică.
2. Experiența 2
Bărbat, cu cancer la plămân cu metastaze la ficat și la oase. A fost supus la 4 ședințe de chimioterapie (campto/carboplatin) și a suferit efecte secundare extreme, constând din greață, o stare de rău și o stare mediocră de sănătate. El a dezvoltat, de asemenea, depresie și crize de anxietate și a avut nevoie de pastile pentru adormit. După 3 ședințe de chimioterapie el a început să ia ceai de vâsc. Astfel, i s-a părut mai ușor să primească a 4-a ședință de chimioterapie, consumând și ceaiul de vâsc. Greața, starea de rău și crizele de anxietate au fost complet eliminate, deși s-a simțit puțin obosit și cumva slăbit. După 9 săptămâni de consum al ceaiului de vâsc, el a raportat că se simte mult mai bine, durerile de spate și disconfortul la nivelul coastelor fiind ușurate. El s-a simțit în general mult mai energic și mai puțin obosit ca mai înainte. Apetitul său s-a îmbunătățit și a luat 10 kg în greutate. Calitatea vieții sale s-a îmbunătățit. A dormit bine noaptea și nu a mai avut nevoie de medicație pentru combaterea durerii și pentru reducerea anxietății. Se pare că ceaiul a fost foarte eficient în cazul acestui bărbat. El nu a notat niciun efect secundar, sistemul său digestiv a funcționat bine și starea sa generală a continuat să se îmbunătățească.
III. Studii clinice care au folosit lectina purificată din vâsc
Într-un studiu clinic, Lenartz și ceilalți (2000) au studiat efectele ML-I asupra pacienților cu gliom malign. Toți pacienții incluși în studiu erau supuși tratamentului oncologic standard recomandat internațional (neurochirurgie, iradiere, îngrijire medicală de bază conform protocolului și indicațiilor). Pacienții au fost împărțiți aleatoriu în două grupe: un grup de tratament (primind imunoterapie complementară, adițională, cu o lectină specifică din vâsc, ML-I) și un grup de control (fără niciun alt tratament complementar adițional). După o perioadă de 50 de luni s-a făcut o evaluare a lipsei recăderilor/supraviețuirii globale. Analiza nestratificată a pacienților în grupul de tratament nu a fost relevantă pentru prelungirea intervalelor dintre recăderi/supraviețuirea globală. Totuși, o analiza prin stratificare a pacienților cu gliom în stadiile III/IV a demonstrat următoarele: 1) o tendința spre supraviețuirea fără recidivare în cazul pacienților din grupul de tratament (17,43 + 8,2 luni) versus grupul de control (10,45 + 3,9 luni); 2) o prelungire statistic semnificativă a supraviețuirii globale în cazul grupului de tratament (20,05 + 3,5 luni), comparativ cu grupul de control (9,9 + 2,1 luni). Datele încurajatoare provenite din acest studiu arată potențialul important al imunoterapiei complementare cu ML-I ca o adiție la tratamentul anticancer standard.
Rezultatele dintr-un studiu clinic de fază I/II, în care un extract de vâsc cu un conținut standardizat de lectină a fost administrat intravezical la 30 de pacienți cu carcinom urotelial la vezică, au fost raportate de Elsasser-Beile și colegii în 2005. Aproximativ la 4 săptămâni după rezecția transuretrală, fiecare pacient a primit săptămânal 6 instilații cu lectină din vâsc cu concentrații între 10 și 5000 ng/ml. Fiecare instilație a fost reținută în vezică timp de 2 ore. O urmărire clinică îndeaproape a inclus citoscopia, citologia și biopsia aleatorie. Lectinele din vâsc administrate intravezical au fost bine tolerate la toate concentrațiile aplicate. Niciunul dintre pacienți nu a prezentat efecte secundare locale sau sistemice, conform clasificării WHO 1-4. Bazați pe observațiile făcute, autorii sugerează că această modalitate de tratament folosind lectinele din vâsc ar putea fi o alternativă utilă în terapia adjuvantă atunci când este vorba despre tratarea cancerul superficial de vezică.
IV. Concluzii
Până acum, metoda cea mai obișnuită de administrare a preparatelor din vâsc a fost injecția subcutanată. Totuși, sunt limitări clare ale acestei abordări: (a) pot fi utilizate doar cantități mici din preparat, (b) doar cantități mici de lectine sunt susceptibile să ajungă la țesutul imunostimulator, (c) locul injecției este foarte „local”, (d) moleculele inhibitoare sunt prezente în sânge, (e) formarea anticorpilor va provoca inevitabil o problemă pe termen lung, (f) o persoană calificată (de ex. o asistentă medicală) este necesară pentru administrarea injecțiilor. Aceste limitări pot fi evitate prin administrarea pe cale orală a unui preparat care conține lectine din vâsc (de ex. un ceai, cum s-a descris mai sus). Deoarece, datorită nivelului lor înalt de glicolizare, lectinele sunt rezistente atât la pH-ul scăzut din stomac și le enzimele proteolitice din intestinul subțire, multe molecule de lectină se vor lega de receptorii lor de la nivelul mucoasei intestinului subțire și vor iniția la momentul cuvenit un răspuns imunitar. Alte răspunsuri importante, precum activarea celulelor naturale ucigașe NK, inducția apoptozei la nivelul celulelor tumorale și inițierea unui efect antiangiogenic într-o tumoare au fost raportate după administrarea orală a unui preparat îmbogățit cu lectine din vâsc. Un avantaj clar al folosirii căii orale de administrare este că lectinele din vâsc pot veni în contact direct cu tumorile care sunt localizate în cavitatea orală, la nivelul esofagului sau al tractului gastrointestinal. Aici, lectinele sunt capabile să-și exercite efectul citotoxic (RIP) asupra acelor tumori care prezintă receptori care permit legarea lanțului B, conducând la internalizarea lanțului A și la inducția apoptozei. Un alt avantaj al folosirii căii orale de administrare este că aceasta nu necesită implicarea personalului medical calificat.
Pe scurt, rezultatele extrem de promițătoare obținute prin folosirea lectinelor din vâsc administrate pe cale orală sugerează că această manieră de folosire a acestor molecule oferă o alternativă atractivă față de practica stabilită de administrare subcutanată. Luând în seamă starea de bine și calitatea vieții unui pacient cu cancer, ingestia orală a unui preparat din vâsc îmbogățit cu lectină, cu o aparentă lipsă de efecte secundare, oferă o alternativă excelentă la tratamentul anticancer convențional, precum chimioterapia. Trebuie subliniat că ingestia orală a unui preparat conținând lectine din vâsc nu poate fi privită ca fiind un „tratament” în sensul obișnuit al cuvântului, deoarece efectul global este doar de a susține și de a întări procesele naturale ale corpului.
p align=





